Az „agyköd” eloszlatása, avagy áttörés az agy pajzsmirigyhormon háztartásának megértésében
A tényeket nem változtatja ugyan meg, mi mit gondolunk róluk, de a mi életünket bizony nagyon is befolyásolja az, mi az általánosan elfogadott álláspont például egy betegség kezelésében. Milliók életére, életminőségére van hatása annak, ha kísérleti eredmények, megfigyelések alapján kiderül, másképp kell gondolkoznunk, paradigmaváltásra van szükség. Ilyesmi történik most a pajzsmirigyhormonnal kapcsolatban, Gereben Balázsék csoportjának aktív közreműködésével.
Felfedezésüket tartalmazó munkájuk a PNAS folyóiratban jelent meg.
Sinkó Richárd, a publikáció első szerzője, annyi mindent kész elmondani nekünk ezzel kapcsolatban, hogy jobb, ha rögtön a dolgok közepébe vágunk. Biztos, ami biztos, azért foglaljuk össze röviden, mit is tanultunk a középiskolában: A pajzsmirigy két fontos hormont termel és tárol. A tirozin-alapú aminosav származék tiroxin (T4) négy, a trijód-tironin (T3) három jódatomot tartalmaz, és a pajzsmirigy-stimuláló hormon (TSH) hatására kerülnek a véráramba. A keringő T4 mennyisége emberben majdnem tízszerese a T3-énak, azonban a hormonhatásért a T3 felelős. Ma már azt is tudjuk, és ez már nem gimnáziumi tananyag, hogy a T4-et a sejtekben a kettes típusú dejodáz enzim (D2) alakítjaT3-má.
- Mit tudunk még?
SR:
- Az utóbbi évtizedekben ismertté vált, hogy a pajzsmirigyhormon (PMH) háztartás szabályozása több szinten történik. A keringő PMH szintek szabályozásáért egy centrális neuroendokrin tengely, a hipotalamusz-hipofízis-pajzsmirigy (HHP) tengely felelős, de a szövetekben egy lokális szabályozórendszer is működik, mely minden szövetben más. Ez teszi lehetővé, hogy minden szövet egyedi módon hasznosítsa a keringő PMH-t, a hormonhatás így szövetspecifikussá válik.
- Ez azonban sajnos nem mindenki esetében történik ilyen tankönyvszerűen . . .
- A PMH háztartás betegségei több száz millió embert érintenek. A leggyakoribb rendellenesség a hipotireózis, vagyis a szisztémás PMH hiány. A kezeletlen hipotireózis, főleg, ha súlyos, pokoli állapot. Egy hosszú távon kezeletlen beteg mindenképpen segítségre szorul, hogy el tudja látni magát, vagy, hogy dolgozni tudjon. Aki sokáig kezeletlen marad, előbb-utóbb belehal, szóval igenis, kezelni kell. A hormonpótlás már néhány nap alatt is drasztikus változást hozhat a beteg életében. Az esetek nagy részében valódi és látványos a javulás.
- Ez ma mit jelent?
- Tiroxin monoterápiát. Jelenleg messze ez a legelterjedtebb kezelési mód. A betegség gyakoriságára pedig jellemző, hogy a hormonpótlásként felírt tiroxin rendre dobogós helyen végez a legtöbbet felírt gyógyszerek listáján.
- Ha jól tudom, a pajzsmirigyhormonnal kapcsolatos betegségek esetében is először állati hormonkészítményeket alkalmaztak. Mondanál erről és a T4 monoterápia bevezetéséhez vezető útról is pár szót?
- Régen mindennemű hipotireózist állati pajzsmirigyőrleménnyel és egyéb készítményekkel kezeltek, ami nem is volt olyan egyszerű, mint amilyennek hangzik. Nem volt mindegy, hogy milyen állatból származik a készítmény, és az ingadozó minőség miatt, adagolása is nehezebb volt.
A tiroxin monoterápiáig vezető út a XX. sz. első harmadáig nyúlik vissza. A tiroxin szerkezete ugyan már a harmincas évekre ismert volt, de ipari előállítása csak évtizedekkel később valósult meg. Sokáig azt sem tudtuk, hogy a T4 mellett T3 is létezik, arra pedig, hogy a T3 a T4-ből a periférián létrejöhet, csak 1970-re derült fény. Ez volt az a paradigmaváltás - gondolkodásmódváltás valamiről új tudományos eredmények alapján -, ami napjainkig alapvető megközelítés a hipotireózis kezelésére.
- Mi lett az új paradigma?
- A szervezetre bíztuk a terápia hatékonyságát! Adjuk a T4 prohormont a betegnek, ami olcsóbb, dózisa könnyebben beállítható, a szervezet pedig majd átalakítja és beállítja a számára optimális hormonális körülményeket. A beavatkozás hatékonyságát a keringő TSH és PMH, de főleg a TSH meghatározásával monitorozzuk/ellenőrizzük, mely szintén az 1970-es években vált rutin diagnosztikai módszerré.
- Mennyire hatékony ez a T4 monoterápia?
- A hetvenes évek óta kiváló eredményeket és valódi javulást hoz a betegek túlnyomó többségének életminőségében. Azonban egyre több eredmény mutatott mostanában arra, hogy az így kezelt betegek nagyjából 15 %-ánál továbbra is fennmaradnak olykor erős, dominánsan idegrendszeri tünetek. Ilyen például az agyköd, de akár depressszió, öngyilkossági gondolatok is előfordulhatnak. És mindez több millió betegre igaz, annak ellenére, hogy keringő TSH szintjét a terápiával normalizálták! Papíron tehát meggyógyult!
- Mielőtt ezzel a 15%-kal kapcsolatban tovább kérdeznék, először hadd tudjam meg, mi az az agyköd?
- Az agyköd több kognitív és mentális diszkomfort, tünet együttállását jelenti. Magában foglalja a memóriazavarokat, hangulatingadozást, levertséget, fáradtságot, amikor az ember nehezebben találja a szavakat, lassabban ért meg dolgokat. Valóban olyasmi, mint amikor az ember gondolatai ködbe burkolóznak.
- Maradt tehát 15%, akiken nem tudunk segíteni? Ez bizony akkor is sok, ha a 85% majdnem hatszor annyi. Legalább valamennyire, de ennek a 15%-nak is használ a kezelés?
- Akik rosszabbul reagálnak a T4 monoterápiára, azok között is vannak eltérések. Egyeseknek használ valamit, de azért még nem érzi magát felhőtlenül jól (vagy inkább agyködtelenül), mások viszont gyakorlatilag semmi változást nem tapasztalnak.
Nagyban nehezíti a maradandó tünetek értékelését az is, hogy a hipotireózis tünetei nem túl egyediek. Nehéz megmondani, hogy valaki azért depressziós, mert valóban az, vagy mert még egy kicsit állítani kellene a T4 adagján. És miért is gondolnánk arra, hogy állítsunk a T4 adagján, ha egyszer a TSH-ja normális, tehát elvileg semmi baja!?
- Mi lehet az oka a 15 %-ba tartozó betegek közötti eltéréseknek?
- Néhány okát már ismerjük. Egyik oka lehet például a D2 enzim polimorfizmusa, mely gyakori, és csak akkor okoz valódi gondot, ha az illető homozigótaként hordozza. Az ő esetében ugyanis a D2 enzim sejten belül nem az endoplazmás retikulum, hanem a Golgi apparátus membránjában foglal helyet. Ugyan az áthelyezett D2 így is képes T3-mat gyártani, azonban az áthelyezés erős stresszt vált ki a sejtben, amit csak komoly erőfeszítések árán képes kompenzálni. Mindez nem is volna baj, de ha az érintett beteg T4 terápiára szorul, akkor a hibás D2 már nem tud megbirkózni a sejtstressz és a megemelkedett T4 együttesével, és rosszul hasznosítja a T4-et. Az ilyen betegek adják a 15 % jelentős részét, és számukra kifejezetten fontos volna valamilyen kiegészítő terápia.
- Van ilyen lehetőség?
- Egyelőre kevés kiegészítő terápia elérhető. A változást támogatók körében a legelterjedtebb nézet a T4+T3 kombinált terápia szélesebb körű használata, ám ez nem minden országban hozzáférhető. Jelenleg még azt is nehéz eldönteni, hogy egy beteg valóban az említett 15%-ba tartozik-e, és a kezelés a beteg számára is nagyobb terhet jelent.
- Kutatásotok oka és időszerűsége további magyarázatra nem is szorul, annál inkább annak hogyanja!
- Először is azt akartuk megtudni, hogyan hasznosul a bevitt T4 az idegrendszerben, és milyen régióspecifikus jellegzetességei vannak a PMH hatásnak T4 többlet mellett. Ehhez a szabadalmaztatott THAI (Thyroid Hormone Action Indicator) egerünket használtuk, melynek segítségével a vizsgált agyrégiók PMH háztartása specifikusan meghatározható. A THAI modellel sikerült bizonyítani, hogy ugyanolyan T4 kezelésre különböző agyrégiók eltérően reagálnak. Míg egyes régiókban ugyanaz a T4 mennyiség normalizálni tudta a PMH hatást, más régiókban elégtelen, vagy éppen túlzó volt. A különböző agyterületeknek tehát más T4 dózisra volna szüksége a lokális PMH háztartás helyreállításához.
- Vajon mi állhat ennek hátterében?
- Ismert, hogy bár a D2 átalakítja a T4-et T3-má, a T4 képes inaktiválni a D2-t. Minél több a T4, annál kisebb hatékonysággal képes az enzim T3-at termelni, mivel átalakítás közben inaktiválódik. Mindezek alapján gyanítható volt, hogy a D2-nél kell keresni a különbségek okát.
A D2 enzim összetett szabályozás alatt áll. A T4 hatására nemcsak inaktiválódik, hanem egy ubikvitinációnak nevezett mechanizmuson keresztül le is bomlik. Ez nagyban gyengíti a T3 gyártást a szövetben. A sejt azonban képes megvédeni a D2-t a lebomlástól. Ezt az ubikvitináció ellentétes folyamatával, a deubikvitinációval éri el. A két folyamatot a sejt nagyon érzékenyen képes szabályozni. A szöveti T3 gyártás így a D2 lebontás és regenerálás érzékeny egyensúlyától függ.
- Hogyan magyarázza ez a T4 felhasználásban az agyterületek között észlelt eltéréseket?
- Fontos hangsúlyozni, hogy az agyban D2-t csak néhány sejttípus termel. Ezek kifejezetten gliasejtek, általában asztrociták. Ezért célszerű volt megvizsgálnunk az asztrociták D2 szabályozását.
A hipotalamuszban azonban egy különleges gliasejttípus, a taniciták termelik a D2-t. A taniciták így a már említett centrális neuroendokrin tengely (HHP) működés, ezáltal pedig a keringő PMH szintek szabályozásának nélkülözhetetlen szereplői. Ezeket figyelembe véve gyanítottuk, hogy a T4 hasznosulásában megfigyelt régióspecifikus jellegzetességek oka a taniciták és asztrociták eltérő D2 szabályozása.
- És mit találtatok?
- Maguknak a sejtkultúráknak a létrehozása sem volt egyszerű, Mohácsik Petra, Halmos Emese és Juhász Andrea azonban nem adta fel. A sejtkultúrák segítségével megmutattuk, hogy az agykérgi és hipotalamikus D2 szabályozás közti különbség egyik fő oka az eltérő deubikvitináció, tehát a D2 enzim védelme. Amíg a taniciták stratégiája a fokozott deubikvitinációval megtartani az enzimkészletet, addig az agykérgi asztrociták T4 többlet mellett feláldozzák a D2-t.
- Ez az eltérő szabályozás velünk született, tehát fontos oka van. Szerinted mi?
- A szöveteknek eltérő helyen, időben és mennyiségben van szükségük a T3-ra, ami jól kézben tartható a D2 lebontásának és regenerálásának finomhangolásán keresztül. Ebben a D2 T4 általi inaktivációja kiemelt szerepet játszik. A hipotalamuszon kívüli felsőbb agyrégiókban a folyamat célja a szöveti PMH háztartás állandóságának fenntartása. A kezeléssel bevitt tiroxin többlet ezeken a területeken túllő a célon és ellentétes hatást ér el. Minél több a tiroxin, annál kisebb lesz a T3 termelés.
A D2 enzim T4 érzékenysége azonban összetettebb a keringő PMH szintek szabályozásáért felelős HHP tengelyt illetően. Normális esetben a keringő hormonszintek negatív visszacsatolás segítségével, önszabályozó módon stabilizálódnak. Vagyis, ha a hormonszint emelkedik, a tengelyműködés mérséklődik, és fordítva.
- Hogyan képes a hipotalamusz érzékelni és szabályozni a keringő hormonszinteket, ha az ehhez nélkülözhetetlen D2 változó hatékonysággal működik?
- A THAI egér segítségével megmutattuk, hogy a hipotalamikus D2 aktivitás ellenálló a T4 szint változásaival szemben. Emiatt a hipotalamusz T3 gyártása érzékenyen tudja követni a keringő PMH szintek változásait, hogy mi is történik a szervezetben. Emiatt tud működni a HHP tengely visszacsatolásos szabályozása. Ez a mechanizmus bevitt T4 többlet esetén is működik és normalizálja a TSH-t, de a hipotalamuszon kívül ez már nem jelenti a PMH háztartás normál működését.
- Mi ennek a jelentősége a T4 terápiára vonatkoztatva?
- A törzsfejlődés során a tömegeket érintő jódhiányos környezet miatt az emlős szervezet kidolgozott alkalmazkodási módokat a csökkent PMH szint leküzdésére, azonban a megemelt T4 bevitel természetes módon nem fordul elő és erre nincs testünknek elég hatékony válasza. Az általunk feltárt mechanizmus ennek a molekuláris okait tárta fel.
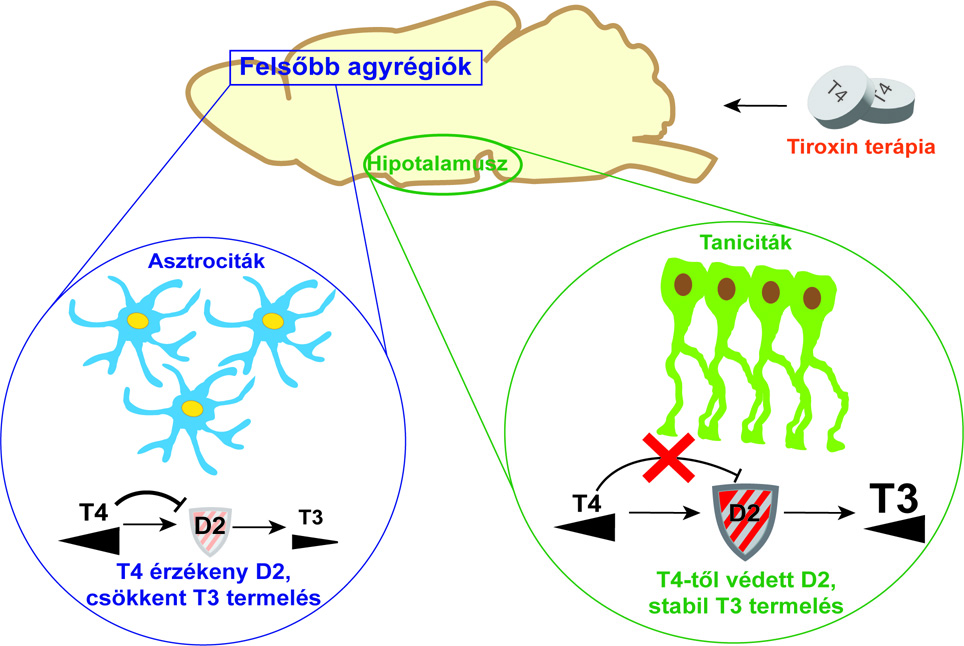
A pajzsmirigyhormon a D2 enzim sejttípus-specifikus szabályozása miatt eltérő hatékonysággal aktiválódik különböző agyterületeken. Emiatt a felsőbb agyterületeken hormonhiány alakulhat ki T4 többlet hatására annak ellenére, hogy a hormonháztartás központjában, a hipotalamuszban, a pajzsmirigyhormon hatás normális. Ez utóbbi következményeként a pajzsmirigyhormon háztartás rutinszerű jellemzésére használt vérparaméterek normalizálódnak.
A munka AC Bianco Chicagói Egyetemen működő csoportja és a Fekete Csaba vezette Integratív Neuroendokrinológiai Kutatócsoport közreműködésével valósult meg. A kutatást az USA Nemzeti Egészségügyi Intézete (NIH) és a Transzlációs Idegtudományi Nemzeti Laboratórium (NKFIH) támogatta. A tanulmány Sinkó Richárd elsőszerzőségével a PNAS folyóiratban jelent meg.






