Összes kutatási terület
Nincs megjeleníthető elem
Ebben a projektben a bazolaterális amygdala lokális kapcsolatait vizsgáljuk.
Centrális és szisztémás gyulladásos mechanizmusok és mikroglia szerepe a gyakori idegrendszeri betegségekben.
In vivo kétfoton [Ca2+] képalkotással vizsgáljuk a hippocampális piramissejtek aktivitásának jellegzetességeit az állat virtuális valóságban történő navigációja közben. Ezt követően a vizsgált sejteket in vitro elektrofiziológiai és posthoc anatómiai vizsgálatoknak vetjük alá, melyek során az intrinsic és szinaptikus tulajdonságok illetve a korábban mért in vivo aktivitás közötti korrelációkat kersünk.
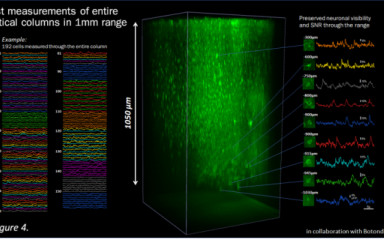
Gyors 3D szkennelés viselkedő egérben
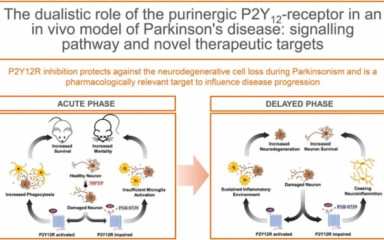
A Parkinson-kór krónikus, progresszív neurodegeneratív állapot; a nigrostriatális dopaminerg pálya degenerációja és neuroinflammáció jellemzi.
Csoportunk új kutatási iránya a védekező viselkedés hátterében álló hálózati mechanizmusok feltárása.
A mediális talamusz és a frontális agykéreg alkotta kapcsolatrendszer fontos szerepet játszik a munkamemória, különböző kognitív folyamatok, az alvás-ébrenlét szabályozásában, illetve az agykérgi oszcillációk kialakításában.
Ebben a projektben az agykéreg és a talamusz közötti kölcsönhatások sokféleségét vizsgáljuk.
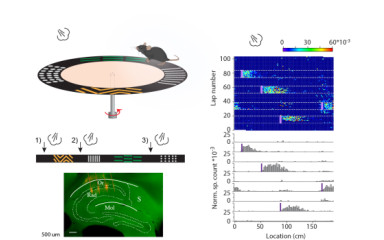
Életünk során elkerülhetetlen, hogy számunkra fenyegetést jelentő szituácókkal nézzünk szembe. A hippokampusz fő, serkentő sejtei, a piramissejtek, az állatok környezetében található helyszínekre és a meglepő, kiemelkedő fontosságú ingerekre vannak hangolva. Ezáltal alakul ki az úgynevezett kognitív térkép a hippokampuszban, ami kulcsfontosságú a viselkedés irányításában. Laboratóriumunkban azt vizsgáljuk, hogy létezik-e a fenyegető ingerekre specifikus kódolási mechanizmus a hippokampuszban.
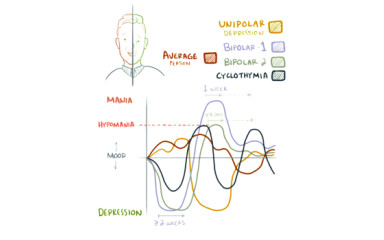
A purinerg diszfunkció részt vesz a mánia és a depresszió kóros folyamatában, de a lényegi összefüggés nem teljesen tisztázott. A purinerg P2X7 receptor (P2X7R) aktivációja központi szerepet játszik a gyulladásban, a mikroglia aktivációjában és az IL-1β felszabadulásában, valamint aktiválja az NLRP3 inflammaszómát. Megvizsgáltuk, hogy a d-amfetamin (AMPH) gyulladásos profilú-e, és a P2X7R-nek van-e hatása az IL-1β-n keresztül ebben a modellben.

VIP interneuronok aktiválása a kéregben jutalmazás és büntetés által

Napjainkra ismertté vált, hogy a pajzsmirigyhormon (PMH) hatás az agyban kompartmentalizált; a glia sejtek felelősek a PMH kettes-típusú dejodáz (D2) általi aktivációjáért és a hormon neuronokhoz való eljuttatásáért, míg a neuronok intracelluláris PMH szintjüket hármas-típusú dejodáz (D3) által katalizált inktiválációval szabályozzák.
A prefrontális kéreg számos magasabb rendű kognitív folyamatban játszik szerepet.
A SARS-CoV2 vírus által okozott fertőzés idegrendszeri következményei és neuroimmunológiai vonatkozásai.
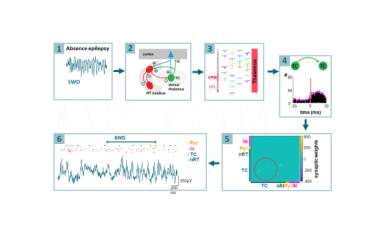
Az absence epilepszia kialakulásában és fenntartásában érintett talamokortikális hálózati elemek szerepének tisztázása a célunk
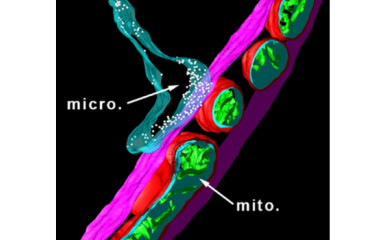
A mikroglia-neuron és mikroglia-vaszkuláris interakciók molekuláris anatómiájának, funkciójának és mediátorainak vizsgálata.
Az egészséges viselkedés, és a függőséghez hasonló betegségek megértéséhez elengedhetetlen a jutalmazásért felelős agyterületek felderítése.

Kutatási tevékenységünkkel hozzá kívánunk járulni annak megértéséhez, hogy a különböző endokannabinoid jelátviteli útvonalak hogyan szabályozzák a szinaptikus plaszticitás bizonyos formáit.

A skizofrénia egy komplex idegrendszeri fejlődési rendellenesség, amely a világ népességének körülbelül 0,5-1%-át érinti, és a rokkantság 10 leggyakoribb globális okának egyike. A legtöbb mentális rendellenességhez hasonlóan a skizofréniát is genetikai, környezeti és társadalmi kockázati tényezők kombinációja okozza, amelyek a génexpressziós szinteket és molekuláris útvonalakat szabályozó epigenetikai mechanizmusok révén kapcsolódnak egymáshoz. Bár a skizofrénia patofiziológiája még mindig nem teljesen tisztázott, egyre inkább tudatosul, hogy az immunrendszer összetevőinek diszregulációja alapvetően összefügg a betegséggel.
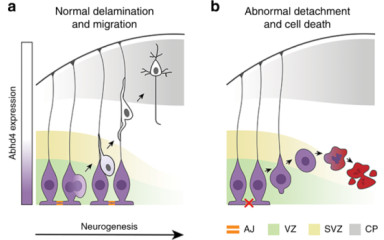
Az egyik legfontosabb endokannabinoid molekula az anandamid. Ebben a kutatási projektben az anandamid nem-kanonikus szintézis enzimeinek, az Abhd4-nek és a Gde1-nek a jellemzésére törekszünk és meghatározzuk az agyban betöltött sokrétű élettani funkcióikat.
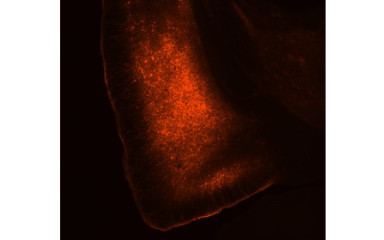
A kéreg alatti moduláció az agykérgi működés nélkülözhetetlen összetevője, és végső soron kulcsfontosságú az adaptív viselkedési válaszok kialakulásában. A kéreg alatti moduláció folyamatában fellépő zavarok pszichiátriai betegségekhez vezethetnek. A pszichiátriai kórképek kutatásában az egyik kulcsfontosságú, de nagyrészt figyelmen kívül hagyott terület, a kéreg alatti moduláció agykérgi visszacsatolással történő szabályzása. Kutatási projektünkben azt vizsgáljuk, hogy a medián raphe működését hogyan befolyásolja a prefrontális kéreg és mi ennek a kérgi visszacsatolásnak a szerepe az emlékezet-vezérelt viselkedési válaszok létrejöttében. Ezen szabályzó mechanizmus megértése segíthet azonosítani a hiányzó láncszemet abban a folyamatban, amely a normális kéreg alatti modulációtól a kóros működéshez, ezzel pedig pszichiátriai kórképek kialakulásához vezet.
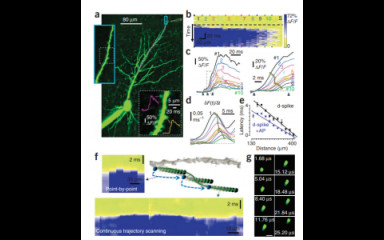
Gyors, három dimenziós képalkotás kétfoton- mikroszkópia segítségével élő, viselkedő állatok neuron hálózatairól
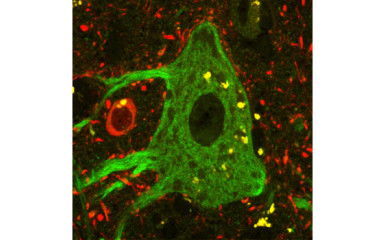
A tatabányai Szent Borbála Kórházzal együttműködve szkizofréniával diagnosztizált páciensek agyi mintáit vizsgáljuk a halált követően, amit idegrendszeri betegséggel nem érintett kontroll alanyokkal hasonlítunk össze. A minták fixálása röviddel a halált követően történik, így azok alkalmasak a finom szerkezeti eltérések kimutatására is.
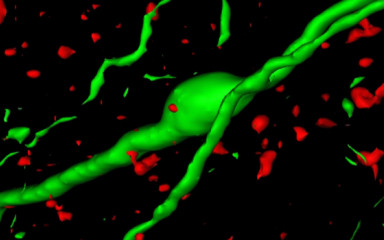
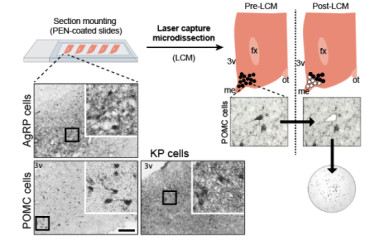
A gonadotropin-releasing hormone hormon (GnRH)-t szintetizáló neuronok a hypothalamus végső kimeneti útvonalát képviselik a reprodukció neuroendokrin szabályozásában. A pulzatilis GnRH-szekréció szabályozza az agyalapi mirigy két gonadotropin, az LH és az FSH hormonjának szintézisét és felszabadulását, amelyek viszont a gonád funkciókat irányítják. A gonadális szteroid hormonok képesek pozitív és negatív visszacsatolási hatást gyakorolni a GnRH-idegsejtek működésére. Az Endokrin Neurobiológiai Laboratórium egyik fő kutatási területe a GnRH idegsejtek alkotta neuronhálózat idegi és hormonális szabályozó mechanizmusok megismerése.
Bár központi szerepet játszik az agyi érzelemszabályozásban, az amygdalával kapcsolatos ismereteink még mindig hiányosak.
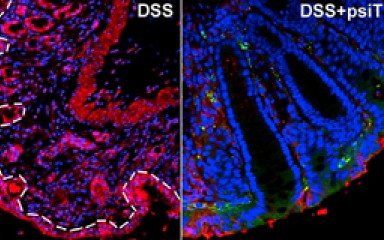
Kutatásaink célja, olyan módosított baktériumok előállítása, melyek a traszkingdom interferencia révén képesek befolyásolni egyes gyulladásos citokinek vagy más gyulladásos mediátorok szintézisét az emlős gazdaszervezetben. A modell lényege, hogy a módosított baktériumok speciálisan tervezett kis hajtű RNS-t (small hairpin RNA) kódolnak, melyek képesek az RNS interferencia révén a gyulladásos citokin expressziójának csökkentésére.
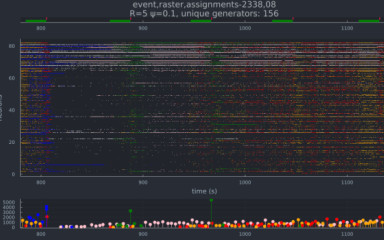
Az idegsejtek átmenetileg kialakuló, egyidejű aktivitása általi információ kódolás elve, az ‘assembly’ hipotézis, már régóta az idegtudomány egyik központi tétele. Assembly-nek hívjuk az időben összehangolt aktivitást mutató idegsejtek csoportját. A hipotézis szerint egy állat cselekedetei sokkal hatékonyabban megjósolhatók a neuronok összehangolt aktivitási mintázatából, mint az egyedi idegsejtek inger- vagy eseményhez kötött tüzeléséből. A nagyagy kérgi és hippokampális hálózatokkal ellentétben, a kéreg alatti modulációs magokban átmenetileg kialakuló populációs mintázatokról még rendkívül keveset tudunk, és nem ismerjük ezen aktivitási mintázatok viselkedési eseményekhez való kapcsolódását sem. Jelen kutatási témánkban a medián raphe-ban (MR) kialakuló assembly-k azonosítása, jellemzése a célunk. A MR fontos forrása a szerotoninnak, ami szinte a teljes agykérget szabályozva fontos szerepet játszik figyelmünk és érzelmeink alakításában, befolyásolva ezáltal szinte az összes kognitív folyamatot. Hipotézisünk szerint a kéreg alatti modulátoros assembly-k összehangolt működése alapvető fontosságú a különböző környezeti változásokra adott adaptív viselkedési válaszok kialakulásában. Ezen összhang megbomlása az életminőséget jelentősen rontó, a társadalom jelentékeny részét súlytó betegségek, mint pl. depresszió, szorongásos kórképek kialakulásához vezethet.
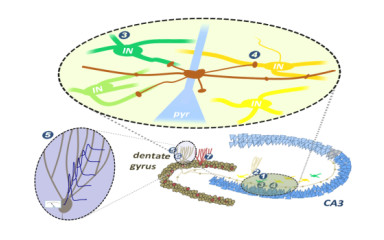
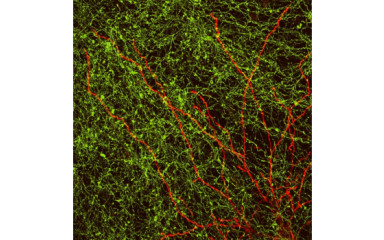
A DG and CA3 agyterületek közötti kapcsolat sejtes elemeiről
Az aktív kutatások és a klinikai tapasztalatok azt mutatják, hogy a Sars-Cov-2-re adott ellenőrizetlen immunválaszt sok esetben pusztító citokinvihar jellemzi (Chaolin Huang 2020). A morbiditás és a mortalitás részben ennek a gyulladásos válasznak a következménye a szervezetben (Ye Q 2020). A betegség lefolyása ismert, hogy terhes nőknél súlyosabb (Kathryn M Moore 2021), azonban a SARS-CoV-2 hatása a fejlődő magzatra jelenleg nem tisztázott. Esettanulmányok azt mutatják, hogy a vertikális átvitel ritka, azonban több tanulmány is alátámasztja, hogy méhlepényi és magzati fertőzések előfordulhatnak (Chen H 2020), (Dong L 2020), (Patanè L 2020). A közelmúltban a Covid-19 fertőzés számos klinikai manifesztációjáról is beszámoltak az idegrendszerben (Desforges M. 2020), (Bohmwald K. 2018).
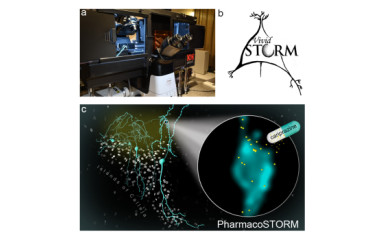
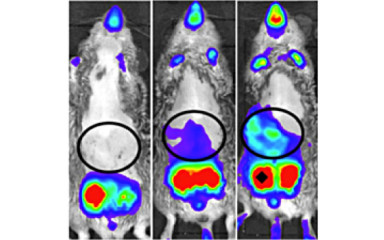
Legújabb tanulmányunk a Nature Communications folyóiratban bemutatja az általunk kidolgozott PharmacoSTORM módszert.
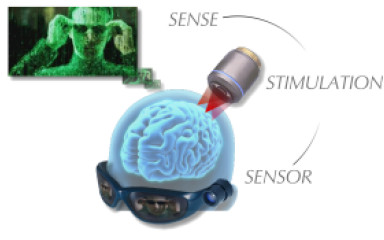
Vizuáls érzet helyreállítás 3D fotostimulációval

Az ASD egy összetett idegrendszeri fejlődési állapot, amelyet környezeti és genetikai tényezők kölcsönhatása okoz. A közelmúltban az anyai vírusfertőzések a terhesség alatt és azok immunológiai következményei, mint az idegrendszeri fejlődési zavarok kockázati tényezői, különös érdeklődésre tartottak számot a kutatásban.
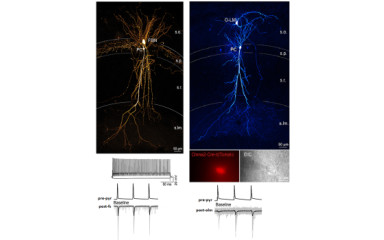
Célunk feltárni a szinapszisok funkcionális sokféleségének hátterében álló molekuláris különbségeket, melyek hozzájárulhatnak például a neurotranszmitter felszabadulás sejtspecifikus tulajdonságainak illetve a szinapszisok rövid távú plaszticitásának kialakításához. E kérdéseket in vitro elektrofiziológia, kétfoton képalkotás, fény- és elekrtonmikroszkópiás immun lokalizáció kombinációival vizsgáljuk.
Ebben a projektben a talamusz szerepét vizsgáljuk a motoros tanulásban.
Ebben a projektben az emberi talamusz szinaptikus szerveződését vizsgáljuk.
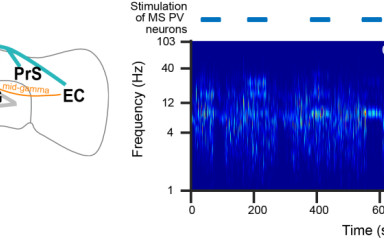
A mediális szeptum modulálja a hippokampusz oszcillációit a théta ritmuson túl is
Míg a HPT tengely biztosítja a keringő pajzsmirigyhormon szintek stabilitását, a pajzsmirigyhormon-transzporterek, metabolizáló enzimek, receptorok és co-regulatorok összetett gépezete biztosítja, hogy a helyi pajzsmirigyhormon hatás megfeleljen a különböző szövetek igen változó igényeinek.

A depresszió - diagnózisa szerint legalább 2 hétig tartó állapot, vezető tünete a letargia és/vagy az öröm-érdeklődés elvesztése - a világon leggyakrabban előforduló pszichiátriai rendellenesség.
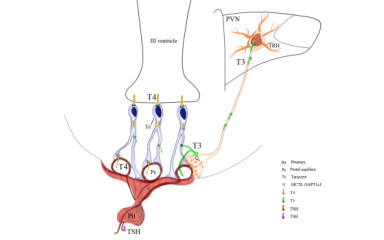
A HPT tengely elsődlegesen a pajzsmirigyhormonok vérben keringő szintjének stabilitásáért felelős, ami a szövetek biológiai működéséhez, többek között az agy fejlődéséhez, a szív- és érrendszeri, csont- és májműködés fenntartásához, a táplálékfelvétel és az energiafelhasználás szabályozásához elengedhetetlen.

A legtöbb ember élete során legalább egy alkalommal traumatikus eseményt él át. Míg a traumát átélők többsége hosszú távú következmények nélkül felépül, azok 10-30%-ánál egy összetett, súlyos és tartós mentális tünetegyüttes, a poszttraumás stressz zavar (PTSD) alakul ki, amely alapvetően csökkenti az életminőséget. A PTSD-ben szenvedő pácienseknél alkalmazott terápiás megközelítések a mai napig nem megoldottak megfelelően. A trauma által kiváltott PTSD kialakulására sérülékeny egyének azonosítása és az ezt a populációt szelektíven célzó kezelési stratégiák alkalmazása nagy klinikai kihívást jelent és komoly terápiás potenciált jelent. A trauma által kiváltott hosszú távú káros viselkedési változásokat csoportunk transzlációs laboratóriumi állatmodell alkalmazásával vizsgálja, mely során célunk a sérülékenység viselkedési markereinek és azok neurális korrelátumainak azonosítása.

Egy széleskörű európai felmérés alapján az összes mentális betegség közül a szorongásos zavarok előfordulása magasan a leggyakoribb, mintegy 34%-ra tehető. Magas előfordulási gyakorisága, illetve súlyos egyéni és társadalmi hatásai ellenére a betegségcsoport hátterében álló neurobiológiai mechanizmusok máig nem teljesen ismertek. Ennek következtében a farmakoterápiás kezelés jelenleg nem kielégítő hatékonyságú, azonban az állatkísérletes kutatások során ígéretesnek bizonyuló új gyógyszercélpontok jelentős százaléka hatástalannak bizonyul a humán klinikai tesztelési fázisok során. Hipotézisünk szerint ennek egy lehetséges magyarázata, hogy a preklinikai szorongástesztek csak az időben fluktuáló és a környezeti hatások által erősen befolyásolt állapotszorongást képesek mérni, így nem alkalmasak a szorongásos betegségek magtünetét képező magas vonásszorongás modellezésére, így hatékonyabb farmakoterápiás célpontok felfedezésének elősegítésére.
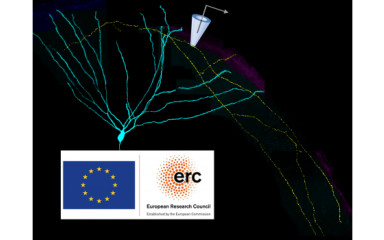
Az axonok jelfeldolgozásban játszott szerepéről

Célunk olyan sejt-típus specifikus celluláris és molekuláris útvonalak alaptudományi azonosítása, amik a hipotireózis tiroxin (T4) monoterápiájára rosszul reagáló betegcsoport tüneteinek hátterében állnak. E betegek TSH-ja a terápia hatására normalizálódik, mégis a szöveti hipotireózis kognitív funkciókat, ill. az energiaháztartás szabályozását kedvezőtlenül érintő tüneteitől szenvednek.

A hipotalamusz-hipofízis-pajzsmirigy tengely (HHP) negatív pajzsmirigyhormon (PMH) visszacsatolást biztosító beállításai („set-point”) a fejlődés során a teljes élettartamra rögzülnek, azonban az optimális szöveti működéséhez szükséges PMH szintek kor-függően változnak. Ehhez a változó igényhez azonban a HHP tengely visszacsatoláson alapuló szabályozása a fix set-point megváltoztatásával nem tud alkalmazkodni, ami hozzájárulhat a szöveti működés korfüggő zavarainak kialakulásához. Célunk annak vizsgálata, hogy léteznek-e olyan mechanizmusok, melyek a HHP tengely rögzült set-point-ja ellenére hozzájárulhatnak a szövetspecifikus PMH háztartás korfüggő szabályozásához. E kérdést különböző korú Pajzsmirigyhormon Indikátor (THAI) egerekben vizsgáljuk.

Hozzájárulásaink más kutatócsoportok munkáihoz
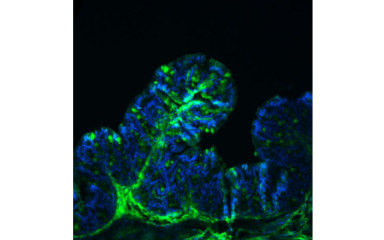
A szervezet és a környezet közti határfelületeket számos mikroorganizmus népesíti be, melyek összeségét mikrobiomnak nevezzük. A mikrobiom által termelt anyagok, különleges anyagcseretermékeik döntő módon befolyásolják a gazdaszervezet működését. A szervezetben a legnagyobb és legösszetettebb a bélben élő mikroorganizmus közösség, a bél mikrobiom, melyet hozzávetőleg 1015 db mikroorganizmus alkot és becslések szerint legalább 1500-2000 különböző faj képviselteti magát. A mikrobiom összetételét számos tényező befolyásolja: a születés módjától, a táplálkozáson át az antibiotikum kezelésig. A mikrobiom összetételét befolyásolni lehet élő baktériumok bevitelével (ezek a probiotikumok), speciális baktérium tápanyagok bejuttatásával (ezek a prebiotikumok) és e két dolog együttes alkalmazásával (ezek a szimbiotikumok).
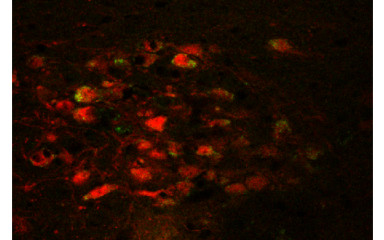
A neuroendokrin stresszválaszt a hipotalamo-hipofizis-mellékvesekéreg rendszer szabályozza. A hipotalamusz paraventriculáris magjában találhatók azok a corticotropin-releasing hormont (CRH) szintetizáló neuronok, melyek integrálják a központi idegrendszer egyéb területeiről származó stresszel kapcsolatos információkat és képesek a megfelelő hormonális stresszválasz elindítására. Stressz alatt ugyanakkor megváltoznak a vegetativ működések, az anyagcsere, az immunfolyamatok és a magatartás is. Kutatásaink célja, hogy feltárjuk azokat a szabályozó mechanizmusokat és neuronális hálózatokat, amelyek koordinálják a stresszválasz egyes elemeit, valamint kimutassuk a hipotalamuszon kívüli, CRH-t expresszáló neuronok szerepét a stressz-integrációban.
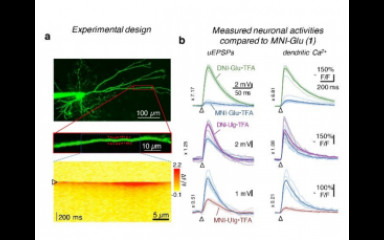
Két-foton uncaging
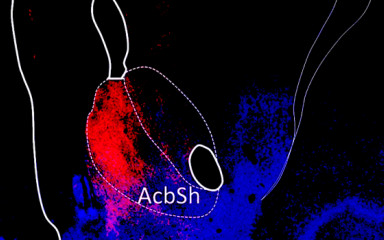
Az Európai Keretprogramok (5-7) támogatásával együttműködünk e tudományterület kiemelkedő európai kutatólaboratóriumaival, hogy új neuronális és hormonális mechanizmusokat tárjunk fel, amelyek központilag szabályozzák az anyagcserét. Ezek a vizsgálatok számos, új szabályozó mechanizmus létére derítettek fényt:
A 17β-ösztradiol (E2) nemi hormon, mely elsősorban az petefészek érő tüszőiben termelődik. A szérum E2-szintjének ciklikus változása a menstruációs ciklus során hatást gyakorolnak a női reproduktív szervekre. Az E2 fontos szerepet játszik a limbikus és agykérgi funkciók fenntartásában is. A menopauza környékén, amikor az E2-szint lecsökken, megnő a kognitív és hangulati zavarok előfordulása, ami hormonpótló terápiával megelőzhető. A Laboratórium egyik hangsúlyos kutatási területe azon molekuláris mechanizmusok megismerése, amelynek révén az E2 az agykérgi és limbikus struktúrákra hatva megőrzi a jó hangulatot, a tanulási képességet és a memória feldolgozás képességét. Az E2 klasszikus hatásait két ösztrogén receptor izoforma, az ERα és az ERβ közvetíti. Ezek ligand-függő transzkripciós faktorok, amelyek E2 jelenlétében szabályozzák a génexpressziót. A prefrontális agykéreg (PFC) és a hippocampus a szteroid hormonok jelátvitelének ismert célpontjai.

A születés körüli oxigénhiányos állapot hatására kialakuló hipoxiás-iszkémiás enkefalopátia (HIE) következtében évente mintegy egymillió újszülött hal meg a világon, a maradandó idegrendszeri károsodást elszenvedők száma pedig ennél is sokkal nagyobb. Még enyhébb kórlefolyás esetén is a HIE hosszú távon neurodevelopmentális betegségekhez, viselkedési, kognitív és pszichiátriai zavarokhoz vezethet. Kutatásunk célja, hogy a HIE hosszú távú hatásainak hátterében álló agyi betegségmechanizmusok transzlációs preklinikai vizsgálatával új potenciális terápiás célpontokat találjunk, illetve olyan biomarkereket azonosítsunk, melyek és a későbbi pszichés zavarok iránti fokozott kockázatot előre jelezhetik.
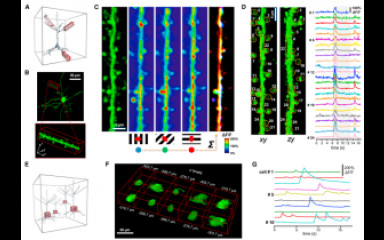
In vivo hálózat mérés

A különböző stresszorokkal való megküzdés elengedhetetlen feltétele a sikeres túléléshez és boldoguláshoz. Mindebben a kognitív és érzelmi folyamatok integrációja zajlik, amit összetett neurális hálózatok végeznek. Patológiás körülmények között a megküzdés túlzottan passzív-elkerülővé válik, mely meghatározója a szorongásos-depresszív zavaroknak. Állatmodellek segítségével a mögöttes agyi mechanizmusok jobban megérthetők, beleértve az egyéni sebezhetőség mechanizmusait is. Rágcsáló modelleket alkalmazva (transzgén egerek, korai életkori stresszorok, sejttípusok manipulációi) vizsgáljuk, hogy a szorongásos-depressziós jellemzők hátterében milyen molekuláris, sejtszintű, vagy neurális hálózatbeli változások azonosíthatók.

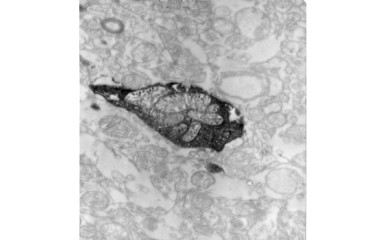
Különféle feszültség- és ligandfüggő ioncsatornák elhelyezkedésének és sűrűségének meghatározása hippocampalis piramissejtek meghatározott szubcelluláris kompartmentjeiben kvantitatív fény és elektronmikroszkópos immunokalizáció segítségével. Eredményeink alapján modellek létrehozása, melyekkel funkcionálisan tesztelhető predikciókat tudunk generálni a speciális ioncsatorna eloszlások funkcionális következményeiről. Modelljeink funkcionális előrejelzéseinek tesztelésére in vitro elektrofiziológiai és képalkotó megközelítéseket alkalmazunk.

A bazális előagyi kolinerg neuronok aktivitásában bekövetkező korfüggő változások in vivo vizsgálata pavlovi kondicionálási feladat során
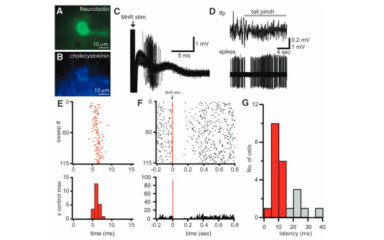
2009-ben leírtuk a kéreg alatti neuromoduláció egy új formáját a medián raphe (MR) - hippokampusz kapcsolatban, amely képes szelektíven és gyorsan aktiválni a hippokampális gátló neuronok egy alcsoportját. A moduláció e rendkívül hatékony formájának funkciója még ismeretlen a hippokampusz reprezentációinak alakításában. Kutatási projektünkben azt szeretnénk megismerni, hogy a fontos eseményhez kapcsolódó kódolási minták alakulását és újjászerveződését hogyan befolyásolja a MR által vezérelt gyors gátló moduláció.
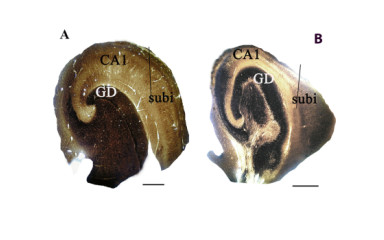
Laboratóriumunk gyógyszerrezisztens epilepszia miatt eltávolított agykérgi szövetet vizsgál, azt rövid post mortem idejű, neurológiai betegségben nem szenvedő kontroll alanyokból származó mintával hasonlítjuk össze. Ennek menetét a honlap “Módszerek” fülén mutatjuk be.
A gyógyszerrezisztens epilepszia három fő oka tumor, a hippocampalis sclerosis és a fokális kortikális dysplasia, és leggyakrabban a temporalis lebenyben alakul ki. Csoportunk és annak elődje számos, interneuronokban és azok kapcsolataiban észlelt elváltozást leírt a hippocampalis sclerosis-sal vagy anélkül kialakult temporalis lebeny epilepszia esetén. Aktuálisan fő vizsgálati területünk a fokális kortikális diszpláziához társuló epilepszia. Ennek keretében leírtuk a parvalbumin-tartalmú periszomatikus beidegzés változásait, és intezíven kutatjuk a cannabinoid-rendszer károsodásait, a mikrogliák és a vér-agy gát elemeinek eltéréseit ebben a betegségben.

A környezetszennyezéssel rohamosan nő azon anyagok, az ún. endokrin diszruptorok mennyisége, melyek a hormonháztartás, köztük a pajzsmirigyhormon (PMH) háztartás működését kedvezőtlenül befolyásolják.
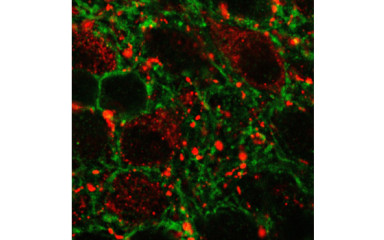
A glucagon-like peptid-1 (GLP-1) egy inkretin hormon. A proglukagon poszttranszlációs feldolgozásából származik. Ezt a prohormont három sejtpopuláció termeli, a bélnyálkahártya neuroendokrin L-sejtjei, a hasnyálmirigy Langerhans-szigeteinek ß-sejtjei és a nucleus tractus solitarii (NTS) és a medulla oblongata intermedier retikuláris magjában található neuronális populáció.
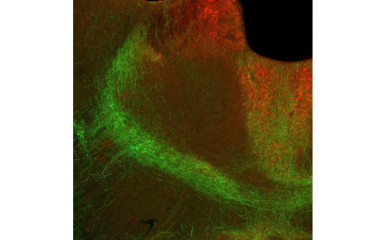
Ebben a projektben a talamusz szerepét vizsgáljuk a stressz által kiváltott viselkedésbeli változásokban.
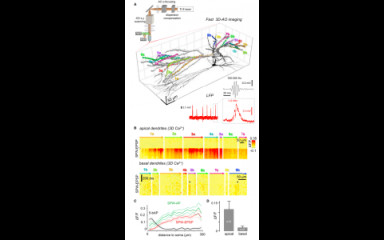
Spontán neuronhálózat aktívitás mérése in vivo

A gyermek szociális környezetében bekövetkező káros hatások - például a bántalmazás vagy elhanyagolás - jelentősen módosíthatják az agy fejlődését, és fokozzák a későbbi pszichés zavarok kialakulásának kockázatát, különösen a szociális viselkedés zavaraival járó pszichiátriai betegségek tekintetében. A korai szociális stressz különböző transzlációs, klinikailag releváns modelljeinek vizsgálatával az a célunk, hogy feltárjuk az érzelmi szabályozásban szerepet játszó agyterületek érési folyamataiban bekövetkező változásokat és azok hosszú távú funkcionális (viselkedési) következményeit, lehetővé téve a háttérben álló idegrendszeri mechanizmusok megértését és új molekuláris célpontok azonosítását.


