Egy kis lépéssel közelebb a skizofrénia megértéséhez
A skizofrénia egy súlyos idegrendszeri megbetegedés, amely több tízmillió embert érint, és élethosszig tartó gyógyszeres terápiát, valamint pszicho-szociális támogatást tesz szükségessé. A hatékony, célzott kezelés érdekében elengedhetetlen a patológiás folyamatok megértése, ehhez pedig szükség van a betegségben érintett agyterületek idegi hálózataiban bekövetkező változások sejt-, szinapszis- és molekuláris szintű feltérképezésére. A Nusser csoport egy olyan áttörő, nagy felbontású eljárást fejlesztett ki, amely lehetővé teszi a szinaptikus fehérjék vizsgálatát egyedi szinapszisok szintjén humán agyszövetben. Ezzel a módszerrel a skizofréniás betegekben szelektív molekuláris változást (csökkent NMDA receptor sűrűséget) fedeztek fel a serkentő szinapszisok egy specifikus alcsoportjában.
A skizofrénia patofiziológiájával kapcsolatban ismert, hogy különösen a kognitív zavarok kialakulásában, kiemelt szerepet játszik a dorzolaterális prefrontális kéreg (DLPC) nevű agyterület. A genetikai és transzkriptomikai adatok a serkentő, glutamáterg szinaptikus jelátvitel zavarára utalnak. Mivel az mRNS mennyisége nem mindig tükrözi arányosan a majd termelődő fehérjék mennyiségét, így a szinaptikus funkció változásait fehérje szinten kell vizsgálni. A korábbi fehérje meghatározások (pl. Western blot segítségével) azonban csak az agykéreg egészének átlagos fehérjetartalmáról adtak képet. A szinaptikus fehérjék eloszlását feltáró, nagyfelbontású mikroszkópos adatok eddig szinte kizárólag rágcsálókból származtak, mivel a posztmortem fixált humán agyszövetek esetében a szinapszisok sűrű fehérjehálózatába ágyazott molekuláit felismerni, detektálni, a mai napig komoly technikai kihívást jelent. Ebben hozott áttörést a Nusser csoport módszertani fejlesztése.
A csoport kutatásainak célja a serkentő szinapszisok molekuláris összetételének feltárása volt egyedi szinapszisok szintjén, posztmortem humán kontroll és skizofrén dorzolaterális prefrontális kéregben. A vizsgálatokhoz a mintákat a KOKI Humán Agyszövet Laboratóriuma biztosította.
Lőrincz Andrea, a cikk első szerzője: „Kutatócsoportunk sikeresen optimalizálta a nagy érzékenységű, beágyazás utáni immunfluoreszcens jelölési eljárást humán szövetre. Módszerünkkel sikerült a műgyantába ágyazott vékony (200-400 nm) metszetekből kvantitatív adatokat nyerni a szinaptikus fehérjék mennyiségéről és eloszlásáról konfokális és STED szuperrezolúciós mikroszkópia segítségével, akár 40 nm-es felbontással. Az erősen fixált humán szövetben egy mikrohullámú antigénfeltárási lépéssel tettük a szinaptikus fehérjéket hozzáférhetővé az ellenanyagok számára. Módszerünk nagy előnye, hogy egy-egy alkalmazott ellenanyag eltávolítása után, több egymást követő lépésben, több tucat különböző fehérje is jelölhető ugyanazokban a szinapszisokban!”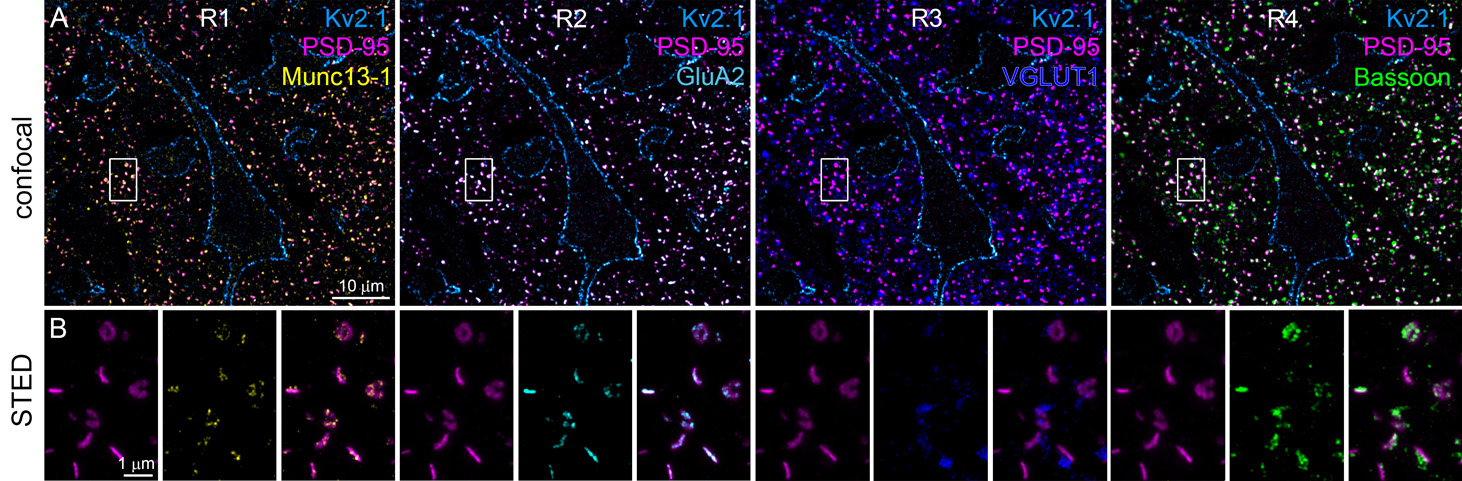
Szinaptikus fehérjék többszörös immunfluoreszcens jelölése humán prefrontális kéregből származó 300 nm vastag metszeten, konfokális és STED mikroszkópos képeken bemutatva. A négy körben (R1-R4) végrehajtott hármas jelölés lehetővé teszi több szinaptikus fehérje pontos térbeli eloszlásának vizsgálatát ugyanazokban a szinapszisokban.
Meglepő eredmény volt a serkentő szinapszisok általános stabilitása. A kontroll és a skizofrén betegek felső kérgi rétegeiben a serkentő szinapszisok sűrűségében és méretében nem volt kimutatható különbség, ahogy az AMPA és NMDA receptorok (GluA2, GluN1, GluN2B alegységek), valamint a preszinaptikus molekulák (Bassoon és Munc13-1) mennyisége is hasonló volt a két csoport között. Még a neurotranszmitter felszabadulási helyek szerveződése is érintetlen maradt a szinapszisok többségében, ami arra utal, hogy a skizofréniával kapcsolatos szinaptikus zavar nem globális, hanem specifikus neuron-típusokra korlátozódhat.
Az irodalomból ismert, skizofréniában érintett sejtek, a parvalbumint-expresszáló (PV+) gátló interneuronok vizsgálata megerősítette azokat a korábbi eredményeket, melyek szerint a skizofrén mintákban a PV+ gátló interneuronok sejttestjeiben a PV fehérje szintje mintegy 30%-kal alacsonyabb a kontroll mintákhoz képest. A közvetlenül a PV+ interneuronok dendritjein lévő serkentő szinapszisok vizsgálata pedig azt mutatta ki, hogy a kontroll és a skizofrén csoportok között ugyan hasonló a szinaptikus AMPA receptorok mennyisége, azonban a skizofrén betegek szinapszisai kevesebb NMDA receptort tartalmaztak.
Lőrincz Andrea:” Eredményeink arra utalnak, hogy a skizofrénia patofiziológiájának kialakulása során az egyes sejttípusok serkentő szinapszisainak molekuláris összetételében történik változás, és nem a prefrontális kéreg összes serkentő szinapszisának átfogó zavara eredményezi. A PV+ interneuronok a hálózati oszcillációk és a kognitív funkciók szabályozásának kulcsszereplői. A rájuk érkező serkentő bemenetekben megfigyelt csökkent NMDA receptorsűrűség arra utal, hogy a skizofréniában sérülhet a PV+ sejtek aktiválhatósága és plaszticitása. Ez megváltoztathatja a serkentő és gátló rendszerek közötti egyensúlyt, ami hozzájárulhat a skizofréniában megfigyelt kognitív hanyatláshoz.
Bízunk benne, hogy módszerünk előmozdítja azon molekulák szerepének feltérképezését, melyek meghatározóak lehetnek a skizofrénia, valamint más neurológiai és pszichiátriai megbetegedések kialakulásában és lefolyásában.”
Lorincz A, Ashaber M, Nusser Z :Altered Molecular Composition of a Specific Subset of Prefrontal Cortical Excitatory Synapses in Schizophrenia. J Neurosci. 2025 Sep 17;45(38):e0645252025. doi: 10.1523/JNEUROSCI.0645-25.2025. PMID: 40829937; PMCID: PMC12444913.






