eMikroszkópok: Melyik mit mutat?
Az alapelvek után nézzük meg most, milyen klasszikus és modern típusai vannak az elektronmikroszkópoknak. A két klasszikus a TEM (transzmissziós, azaz átvilágító EM) és a SEM (szkenning, letapogató EM). Mindkettő megfelelően előkészített mintát igényel a képalkotáshoz. A TEM hasonlóan egy klasszikus fénymikroszkóphoz egy vékony metszetet „világít” meg elektronokkal.
A kép úgy alakul ki, hogy a minta különböző részei eltérő mértékben engedik át, illetve nyelik el vagy szórják az elektronokat. A vizsgálni kívánt szövetet az előkészítés során nehézfémsókkal, urán, ólom és ritkábban wolfrám sóival reagáltatják. A sók különböző mértékben kötődnek a fehérjékhez és elsősorban a sejthártyát alkotó zsírokhoz és eltérő erősségű árnyékot adnak majd. A feldolgozás hosszadalmas lépése, hogy a mintát műgyantával kell átitatni, majd hőkezeléssel kikeményíteni. Erre azért van szükség, mert a vizsgálandó metszetnek nagyon vékonynak, 40-70 nanométer vastagnak kell lennie, hogy ne nyelje el az össze elektront. Ilyen vékony metszetet, pedig csak egy kemény anyagból lehet vágni, speciálisan csiszolt, gyémántból készült pengékkel egy nagyon precíz szerkezeten, melyet ultra-mikrotómnak hívnak. A metszetkészítéshez kézügyesség, nyugalom és türelem kell. Tudományos munkám egyik legkedvesebb része ezen metszetek elkészítése volt, mert egy félreeső csendes, nyugodt helyen Zen nyugalomban lehetett csak ezt csinálni.

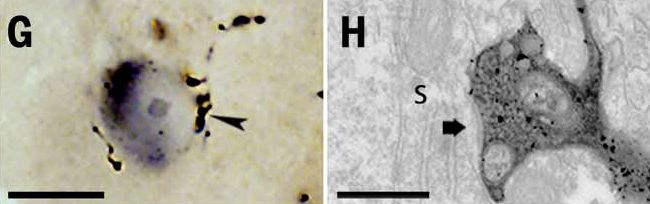 Az elkészült metszeteket a mikroszkópba helyezve jöhet a keresgélés. A TEM-et arra lehet használni, hogy a sejtek, sejtalkotórészek, nyúlványok és a közöttük található szinapszisok tulajdonságait vizsgáljuk. A minták előkészítésekor immunfestéssel EM vizsgálatra is
Az elkészült metszeteket a mikroszkópba helyezve jöhet a keresgélés. A TEM-et arra lehet használni, hogy a sejtek, sejtalkotórészek, nyúlványok és a közöttük található szinapszisok tulajdonságait vizsgáljuk. A minták előkészítésekor immunfestéssel EM vizsgálatra is 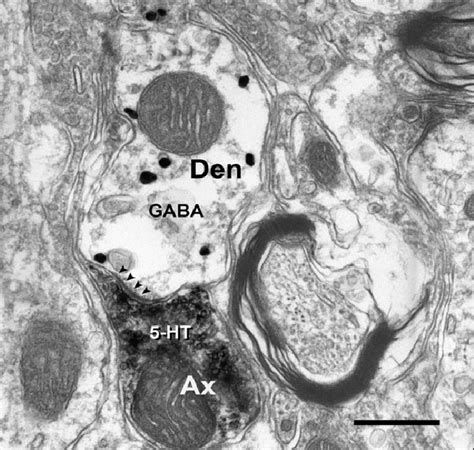 megjelölhetők sejttípusok vagy azonosítható különböző típusú molekulák pontos elhelyezkedése, azáltal, hogy az anyagokhoz kötődő antitestekhez apró 5-15 nm-es, elektronokat elnyelő aranyszemcséket kötnek, vagy a fénymikroszkópban is használt DAB jelölésre elektronokat elnyelő fémsókat csapnak ki.
megjelölhetők sejttípusok vagy azonosítható különböző típusú molekulák pontos elhelyezkedése, azáltal, hogy az anyagokhoz kötődő antitestekhez apró 5-15 nm-es, elektronokat elnyelő aranyszemcséket kötnek, vagy a fénymikroszkópban is használt DAB jelölésre elektronokat elnyelő fémsókat csapnak ki.
TEM-el azonosíthatók a fénymikroszkópban két sejt között megfigyelt, feltételezhető kapcsolatok, és tulajdonságaik. Illetve, hogy egy szinapszisban pontosan hol helyezkednek el az eltérő típusú transzmitterek receptorai és egyéb moduláló molekulák.
Ennek legérdekesebb módszere a freeze-fracture replica labelling. Ezt akkor most fordítsuk le. A freeze-fracture azt jelenti, hogy fagyasztva törés. A mintánkat folyékony héliumban keményre fagyasztjuk, majd egy megfelelő szerkezetben kettétörjük. Amikor egy anyag törik, a törésvonalak mindig a leggyengébb helyek felé futnak. Egy biológiai mintában leggyakrabban a kétrétegű sejthártya két rétege mentén válnak el a felszínek, mivel itt a leggyengébb az összetartó erő. A sejtplazma vizes oldata és a fehérjék erősebben kötöttek (hidrogén hidakkal és kovalens kötésekkel) mint az apoláris zsírmolekulák (a között ható van der Wals kötések gyengék). Egy fagyasztva tört minta felszíne tehát axonterminálisok, dendritek, mitokondriumok felszínén fut, úgy néz ki mint egy dombormű, és alkalmas arra, hogy megvizsgáljuk ezeken a sejtalkotórészeken milyen molekulák és hol helyezkednek el.
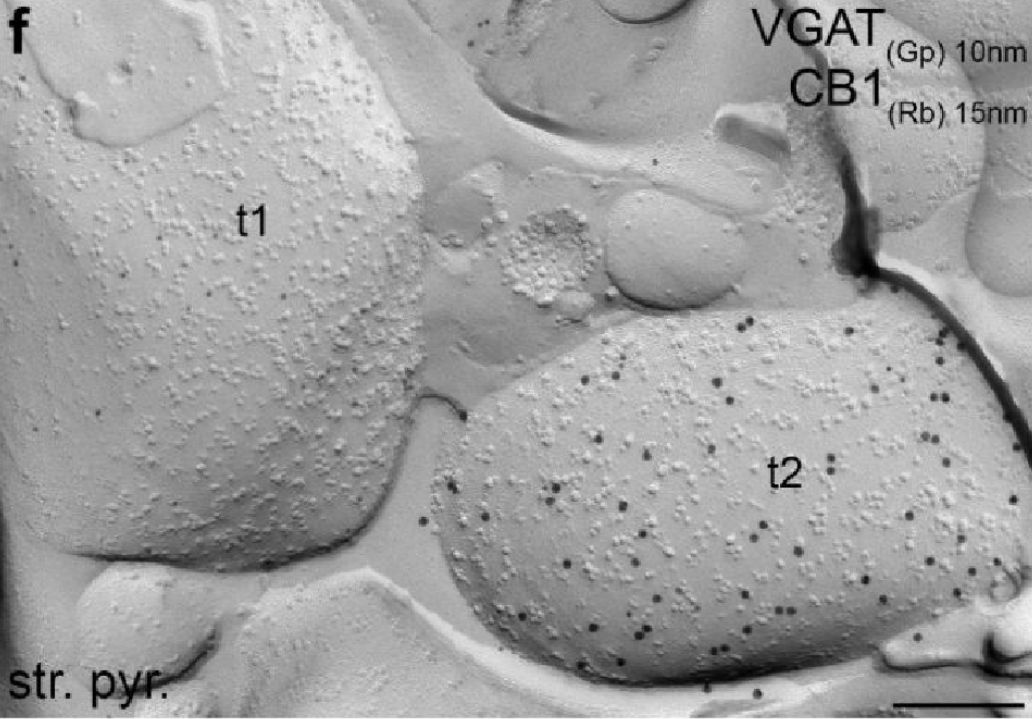 No de hogyan látjuk ki hol van? Itt jön a replica labelling rész. Azaz másolat jelölés. A szétválasztott, két egymással szembe néző felszínre szén és platina atomokat gőzölnek, hogy legyen egy hordozó réteg, mely a fagyasztott minta felolvasztása után is merev marad. Ezekről a felszínekről azután leemésztik a biológiai anyag nagy részét. A dolog kicsit ahhoz hasonlít, mint amikor egy lábnyomot kiöntünk gipsszel, hogy megőrizzük. A kiemelt és letisztított gipszfelszín megőrzi a lábnyomot és apró kavicsok, fűszálak tapadnak bele. Itt csak a szénbe-platinába ragadt fehérje molekulák maradnak, melyeket aztán antitestekkel azonosítani lehet. A különböző típusú antitestekhez különböző méretű aranyszemcséket kötnek és így a replikáról készített EM képen majd az eltérő méretű aranyszemcsék felhalmozódása jelzi, hogy a felszínre bukkant axonvégtalpak vagy dendritdarabok mely részén milyen fehérjék és milyen viszonyban helyezkednek el. Térképet rajzolhatunk arról, hogy az ingerületátvitelben fontos receptorok és moduláló molekulák, illetve az elektromos jelek továbbításában, hangolásában fontos ioncsatornák az idegsejtek mely részein, milyen mennyiségben találhatók.
No de hogyan látjuk ki hol van? Itt jön a replica labelling rész. Azaz másolat jelölés. A szétválasztott, két egymással szembe néző felszínre szén és platina atomokat gőzölnek, hogy legyen egy hordozó réteg, mely a fagyasztott minta felolvasztása után is merev marad. Ezekről a felszínekről azután leemésztik a biológiai anyag nagy részét. A dolog kicsit ahhoz hasonlít, mint amikor egy lábnyomot kiöntünk gipsszel, hogy megőrizzük. A kiemelt és letisztított gipszfelszín megőrzi a lábnyomot és apró kavicsok, fűszálak tapadnak bele. Itt csak a szénbe-platinába ragadt fehérje molekulák maradnak, melyeket aztán antitestekkel azonosítani lehet. A különböző típusú antitestekhez különböző méretű aranyszemcséket kötnek és így a replikáról készített EM képen majd az eltérő méretű aranyszemcsék felhalmozódása jelzi, hogy a felszínre bukkant axonvégtalpak vagy dendritdarabok mely részén milyen fehérjék és milyen viszonyban helyezkednek el. Térképet rajzolhatunk arról, hogy az ingerületátvitelben fontos receptorok és moduláló molekulák, illetve az elektromos jelek továbbításában, hangolásában fontos ioncsatornák az idegsejtek mely részein, milyen mennyiségben találhatók.
Mivel a szövetből csak nagyon vékony (40-70 nm) elektronmikroszkópos metszeteket készítünk, a 3D struktúráknak csak 2D síkmetszeteit látjuk. Amennyiben 3Dben szeretnénk megérteni a vizsgált dolgok felépítését lehetőség van arra, hogy egymás után vágott több tucat vagy több száz metszeten ugyanazon területet lefényképezve 3Dben rekonstruáljuk a viszonyokat. A feladat szemléltetéséhez képzeljük el, hogy beteszünk egy tál makarónit a hűtőbe, amiben néhány húsgolyó van belekeverve. Amikor másnap kivesszük, az egész összedermed egy merev gombolyaggá. Ha ebből vágunk egy szeletet akkor látjuk síkban (2D) hogyan helyezkednek el a tekergő tészták és a húsgombócok. Ha vágunk egy másik szeletet újabb 2D síkot látunk. Ha kellően sűrűn és sok szeletet vágunk akkor kibogarászhatjuk hogyan futnak a makaróniszálak és hogyan veszik körül a húsgolyókat.
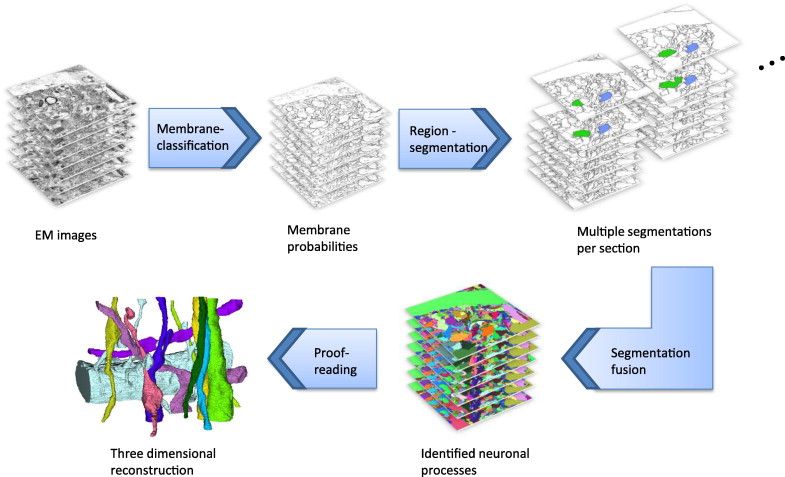
A 3D megjelenítés alkalmas arra, hogy számszerűsítsük egy-egy nyúlványon hány szinapszis található vagy egy axonvégződésben mennyi szinaptikus hólyagocska és átvivőanyag receptor található és hol. A későbbiekben bemutatott modern EM-ek ennek a folyamatnak a gyorsítására ravasz technikai trükköket használnak.
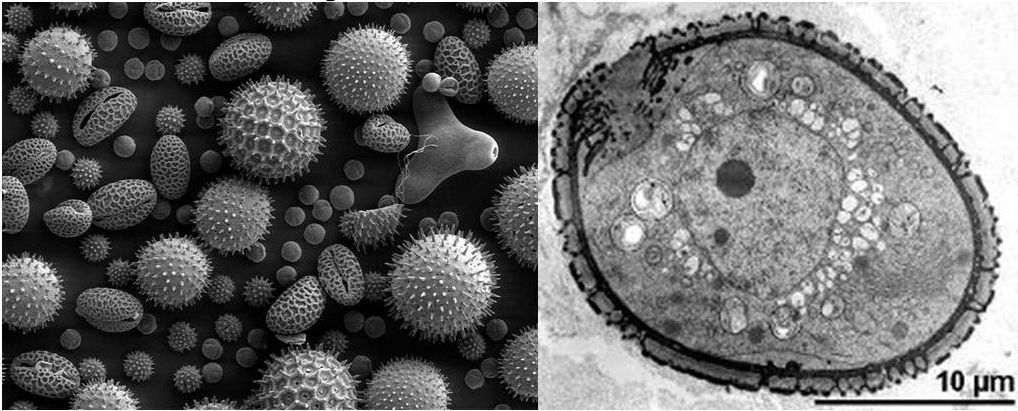
A SEM-et, a pásztázó (szkennelő) EM-et az agykutatásban ritkán használják. Ezekkel a mikroszkópokkal inkább kisebb nagyításban (200-2.000X) vizsgálnak rovarokat, egyedülálló sejteket, vírusokat. A mintákat itt is elő kell készíteni. A minták felszínére néhány atom vastag szén vagy arany réteget gőzölnek. A mintákat a SEM-ben nem átvilágítják, hanem egy vékonyra fókuszált elektronsugárral letapogatják. Az egyes pontokról visszaverődött elektronok mennyiségét mérik és így alkotnak képet, mely nagyon jól mutatja a minták felszínének apró részleteit 3D-ben. A SEM-ekről nem is ejtünk több szót, csak a TEM-ek továbbfejlesztett változatait és SEM-ekkel alkotott hibridjeit fogjuk megismerni, mert ők fontosak az agy működésének kutatásában.
Az egyik egyszerű továbblépés, amikor az elektronok gyorsítófeszültsége nagyobb, mint a normál TEM-ben. A nagyenergiájú elektronokkal egyrészt finomabb felbontással vizsgálható a szerkezet, még nagyobb fehérjemolekulák alakja és kapcsolódásuk módja is kivehető. De így vastagabb (több elektront elnyelő) minták szerkezetét is vizsgálhatjuk.
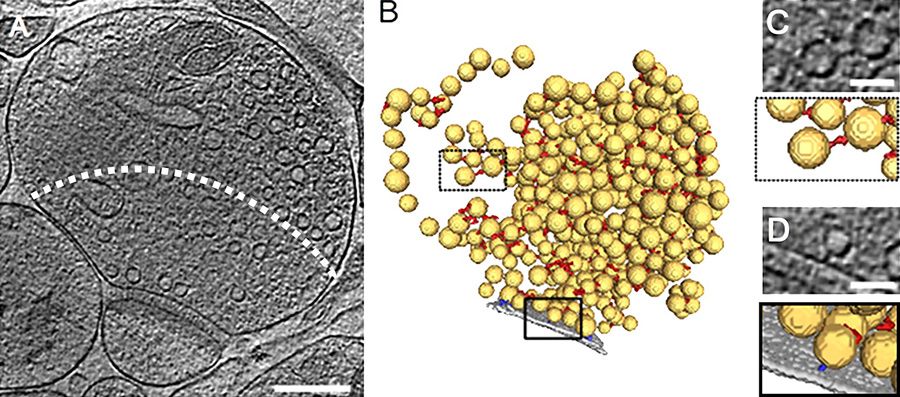
A TEM tomográfia (elektron tomográfia) hasonlóan működik a röntgen tomográfiához, amit CT néven ismernek a laikusok. A tomográfia lényege, hogy különböző irányokból számtalan szögből lefényképezzük, hogy a mintán hogyan jutnak át az elektronok (ezek mindegyike egy 2D TEM fénykép). Ezek után az egyes képek szögelfordulását ismerve egy számítógépes algoritmussal visszafejthető hogyan is helyezkedtek el 3Dben az elektronokat eltérő mértékben elnyelő struktúrák. Ezzel sejtalkotórészek, sejten belüli kapcsoldási viszonyok és molekulahalmazok 3D szerkezetét lehet feltárni.
A TEM-nek és a SEM-nek létezik egy hibridje (Scanning TEM). Itt pontonként világítanak meg egy TEM mintát és az átjutó elektronok mennyiségét mérik. A kép itt élesebb és kontrasztosabb, mint egy sima TEM-ben. Hasonló a különbség, mint egy klasszikus filmre készült kép és egy soroknént kiolvasott CCD chipből kapott kép között.
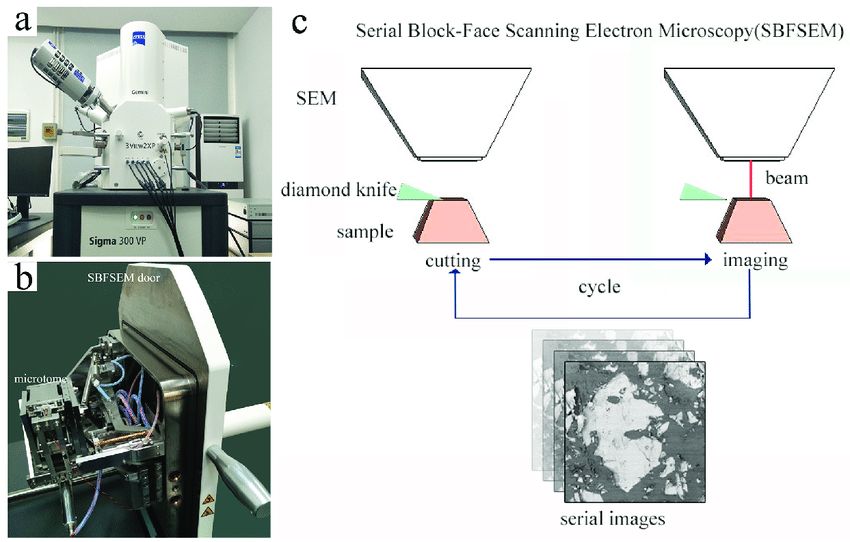
A 2D metszetsorozatokból készíthető 3D rekonstrukciók iránti igény több sorozatrekonstrukcióra alkalmas EM-et is eredményezett. Az Array SEM-hez szilikon lapokra metszik gyémánt késsel a metszeteket és ezen szkenneli be egy elektronsugár a mintákat finom felbontással. A block face SEM, egy olyan szörnyeteg, amibe egy ultramikrotómot építenek be egy TEM-be. Miután a mikrotóm levágott egy vékony szeletet, a minta felszínét beszkennelik, majd újabb metszetet vágnak le és újra szkennelik. Ennek változata, ahol a metszet felszínéről nem késsel távolítanak el egy réteget, hanem fókuszált ionsugárral elpárologtatják. Két párologtatás között pedig szkennelnek.
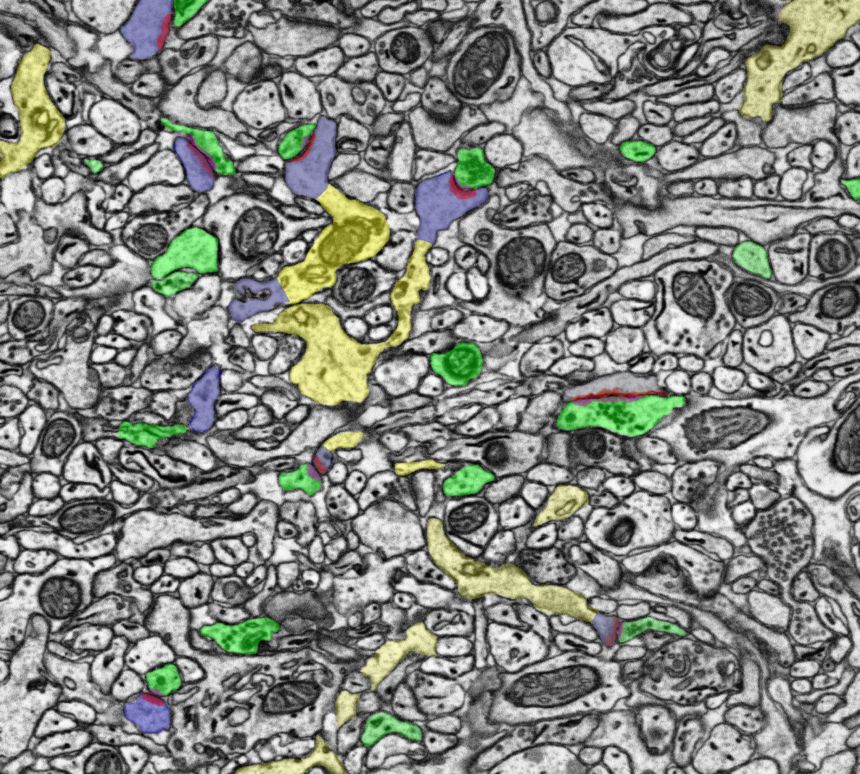
Ezekkel a módszerekkel mostanra már irgalmatlan adatmennyiségeket állítanak elő, több száz mikron, közel milliméter élhosszúságú és vastagságú kockákban sikerült már akár teljes sejtek nyúlványrendszerét és a körülöttük található több millió más nyúlványt digitalizálni.
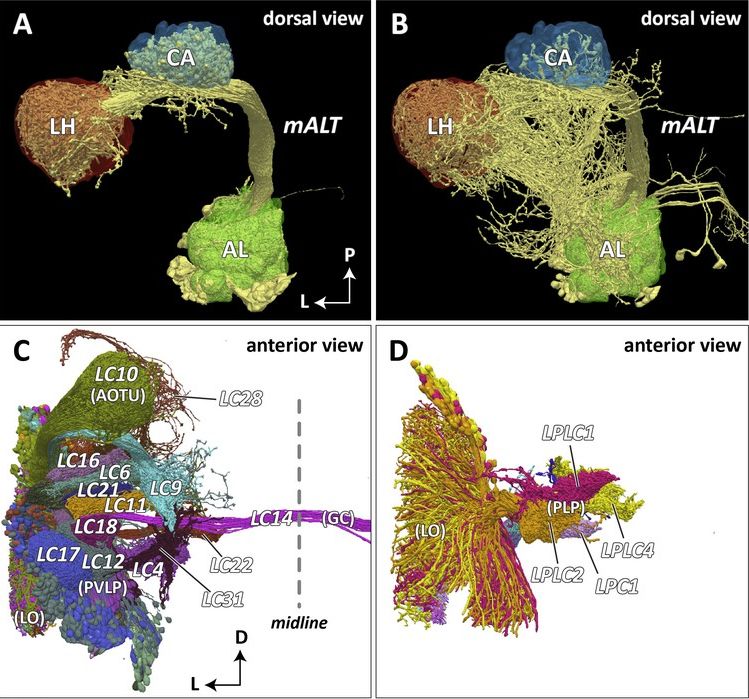 Tíz éve még fárasztó kézi munka volt a 3D rekonstrukció. Mostanra már komoly software támogatással történik a rekonstrukció, bár még így is kemény munka megtalálni, merre szaladnak és kihez tartoznak a nyúlványok. A legújabb fejlemény a mesterséges intelligencia (AI) bevetése az azonosításban. Ezek segítségével igazi big-data módon szabadon hozzáférhető adatbázisokban keresgélhetnek a kutatók, hogy a fáradtságos munkával előállított 2D adathalmazból minél több információt nyerhessenek ki. Ennek eredményeként már dolgoznak a kutatók azon, hogy egy féreg vagy egy muslinca teljes idegrendszerében feltérképezzék az egyes sejtek kapcsolatrendszerét.
Tíz éve még fárasztó kézi munka volt a 3D rekonstrukció. Mostanra már komoly software támogatással történik a rekonstrukció, bár még így is kemény munka megtalálni, merre szaladnak és kihez tartoznak a nyúlványok. A legújabb fejlemény a mesterséges intelligencia (AI) bevetése az azonosításban. Ezek segítségével igazi big-data módon szabadon hozzáférhető adatbázisokban keresgélhetnek a kutatók, hogy a fáradtságos munkával előállított 2D adathalmazból minél több információt nyerhessenek ki. Ennek eredményeként már dolgoznak a kutatók azon, hogy egy féreg vagy egy muslinca teljes idegrendszerében feltérképezzék az egyes sejtek kapcsolatrendszerét.
Van még néhány más irányú fejlesztés is. A fenti elektronmikroszkópos módszerek hátránya az, hogy a klasszikus TEM vizsgálathoz az élő szövetet roncsoló beavatkozásokkal ki kell vonják a vizet a mintából, aminek hatására a fehérjék és a fehérjecsoportokból összeállt molekuláris „gépek” szerkezete megváltozik. Mivel az EM-ben vákuum van, eredeti állapotban levő, víztartalmú mintát nem lehet egy EM-be helyezni, mert a víz azonnal elforrna a vákuumban. A probléma megoldására fejlesztették a Cryo-TEM, azaz a fagyasztásos TEM technikát. Ha a vizsgálandó mintát villám gyorsan lehűtik, a molekulák eredeti állapotukba fagynak. Ha a metszés és a vizsgálat alatt is hűtik a mintát, azt a folyékony nitrogén -170 C fokos hőmérsékletén tartva a fehérjék szerkezetét megőrző jég nem szublimál el és a minták vizsgálhatók. Ehhez a TEM-et a finom felbontású módok: cryo elektron-tomográf, elektron diffrakció vagy single particle analysis (egy részecske vizsgálat) valamelyikében használják. Ezek a módszerek mára kiváltották a korábbi molekulaszerkezetet vizsgáló módszereket, mint a Röntgen krisztallográfia vagy az NMR (mag mágneses rezonancia).
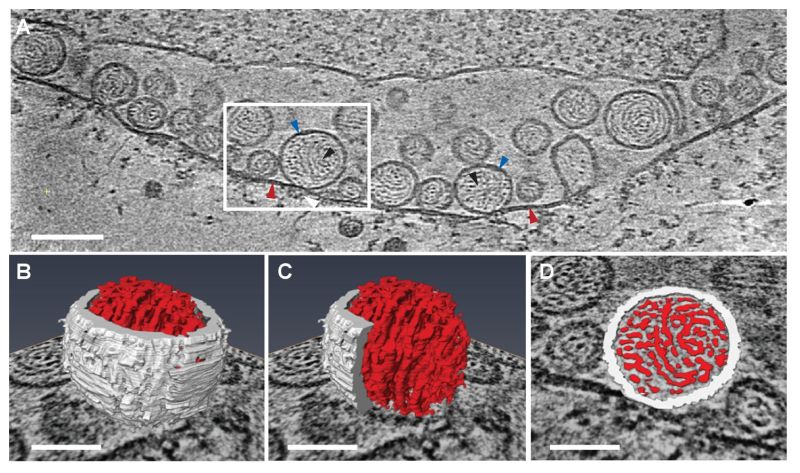
Ezzel végére értünk a mikroszkópok világának. A molekuláris biológia fegyvertárát, majd az agyi képalkotó technikákat vizsgájuk meg az #agytechnikák rovat következő bejegyzéseiben.
Szerző: Gulyás Attila





