Gyógyszerészeti gyorstalpaló II: hol és hogyan?
Ugyan nem értünk még végig az agysétán, de azt már tudjátok, hogy az agyműködést érdemes 4 szinten megközelíteni: 1) az idegsejtek, 2) kishálózatok, 3) agyi területek és 4) a területek tér és időbeli kölcsönhatásának szintjén. A különböző hatóanyagok (leggyakrabban) a fehérjék, és ezáltal a sejtek szintjén avatkoznak be. De mondhatjuk azt, hogy vannak sejt és hálózati szintű hatások.
Bizonyos anyagok az ioncsatornák és ionpumpák működését hangolva megváltoztathatják az idegsejtek jelfeldolgozását és ionháztartását. Így a sejtek jelösszegzése, tanulási folyamatai, tüzelési küszöbe vagy akciós potenciál gyakorisága változhat. Ha a hatóanyag az átvivőanyag receptorok és a sejtközötti térben található molekulák forgalmában résztvevő rendszerek működését változtatja, a hálózati kapcsolatok erőssége, időbeli viselkedése, azaz a hálózat működése változhat. Illetve hát a hatóanyagok nem csak az idegsejtekre, hanem pl. a gliasejtek működésének módosítása is hathatnak, amelyek szintén számos sejt és hálózati hatást váltanak ki.
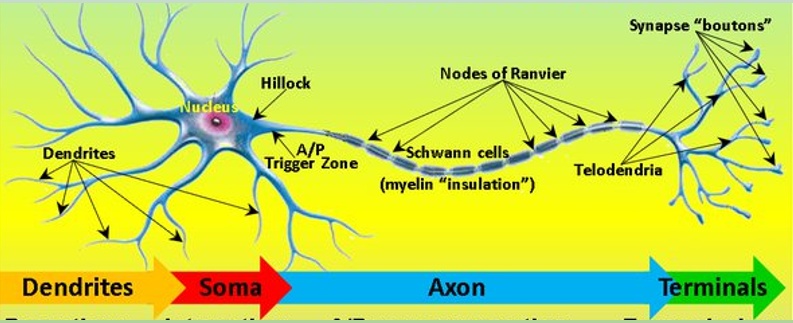
Ha elővesszük az idegsejtek szerkezetéről és jelfeldolgozásáról szóló ábrát akkor a hatóanyagok hatását hozzá lehet rendelni a sejt egy-egy részéhez, annak megfelelően, hol találhatók azok a molekulák, amelyekre hatnak.
Hogy egy hatóanyagnak milyen erős vagy kifinomult hatása van agyműködésünkre függ attól a 4 szint melyikén és milyen erősen hat. Az altatók például alapvető ingerületátviteli folyamatokba szólnak bele, majd minden sejt szintjén, ezáltal szétkapcsolják az agy működését. Nyilván itt is vannak szintek. Az altaók túladagolásába könnyen bele lehet halni, mert az agy teljesen leállhat. Az anaszteziológusoknak penge élén kell táncolniuk, hogy a beteg ne érezzen fájdalmat, ugyanakkor ne essen kómába. A skála másik végén a tudat finom működését módosító szerek találhatók. Ezek csak bizonyos agyterületeken és ott is bizonyos sejteken, csak apró hatásokat váltanak ki, ezáltal a megváltoztatják az agyi területek közötti pontosan hangolt tér és időbeli kapcsolatokat, melyek fontosak egészséges tudatunk kialakításában. Ami fontos még itt, hogy az agyban található több ezer idegsejttípus a DNS-ben kódolt fehérjekészletéből, csak rá jellemző molekulákat gyártja le és épít be. Ettől lesznek ugye képesek arra, hogy szakfeladatukat elvégezzék. Mindenki máshogy szakosodik, mint a mesteremberek a társadalomban, más szerszámokkal mást csinálnak, de egy ház elkészüléséhez mindannyiukra szükség van. Ráadásul egy-egy feladatot betöltő fehérjének több változata is létezhet. Ezek a változatok kicsit eltérő módon működnek és az agy más részein használják őket a sejtek. Mivel kicsit eltérő a 3D szerkezetük, ezért más az elektromos töltéseloszlásuk, eltérő hatóanyagok kötődhetnek hozzájuk. Vannak olyan hatóanyagok amik egy fehérje összes változatához kötődnek és vannak olyanok amelyek csak egyes változatokhoz, az utóbbiakkal jóval célzottabb hatás érhető el. Az epilepszia gyógyszerek az utóbbi évtizedekben például sokat fejlődtek. Az epilepszia az agyi serekentő és gátló folyamatok egyensúlyának megbomlása miatt alakul ki. Ha a gátló idegsejtek hatását erősítjük, bizonyos epilepsziák kialakulása gátolható. Az előző bejegyzésben bemutatott GABAa receptor itt a támadáspont. Bizonyos anyagok hatására (benzodiazepinek), a gátló ingerületátvivő anyaga, a GABA felszabadulásakor hosszabb ideig marad nyitva, azaz a célsejtek erősebben gátlódnak. A korai epilepszia gyógyszerekkel az volt a baj, hogy az agy majd minden pontján fokozták a gátlást. Ezért a beteg igaz epilepsziás nem volt, de nagyon passzívvá, cselekvésképtelenné, álmossá vált. Azáltal, hogy a benzodiazepinek olyan változatait fejlesztették ki, melyek csak az agy bizonyos helyein található GABAa receptorokhoz kötődnek, jelentősen csökkent az epilepszia gyógyszerek „tompító” hatása, ami komoly életminőség javulást hozott az epilepsziások számára.
Ami fontos még itt, hogy az agyban található több ezer idegsejttípus a DNS-ben kódolt fehérjekészletéből, csak rá jellemző molekulákat gyártja le és épít be. Ettől lesznek ugye képesek arra, hogy szakfeladatukat elvégezzék. Mindenki máshogy szakosodik, mint a mesteremberek a társadalomban, más szerszámokkal mást csinálnak, de egy ház elkészüléséhez mindannyiukra szükség van. Ráadásul egy-egy feladatot betöltő fehérjének több változata is létezhet. Ezek a változatok kicsit eltérő módon működnek és az agy más részein használják őket a sejtek. Mivel kicsit eltérő a 3D szerkezetük, ezért más az elektromos töltéseloszlásuk, eltérő hatóanyagok kötődhetnek hozzájuk. Vannak olyan hatóanyagok amik egy fehérje összes változatához kötődnek és vannak olyanok amelyek csak egyes változatokhoz, az utóbbiakkal jóval célzottabb hatás érhető el. Az epilepszia gyógyszerek az utóbbi évtizedekben például sokat fejlődtek. Az epilepszia az agyi serekentő és gátló folyamatok egyensúlyának megbomlása miatt alakul ki. Ha a gátló idegsejtek hatását erősítjük, bizonyos epilepsziák kialakulása gátolható. Az előző bejegyzésben bemutatott GABAa receptor itt a támadáspont. Bizonyos anyagok hatására (benzodiazepinek), a gátló ingerületátvivő anyaga, a GABA felszabadulásakor hosszabb ideig marad nyitva, azaz a célsejtek erősebben gátlódnak. A korai epilepszia gyógyszerekkel az volt a baj, hogy az agy majd minden pontján fokozták a gátlást. Ezért a beteg igaz epilepsziás nem volt, de nagyon passzívvá, cselekvésképtelenné, álmossá vált. Azáltal, hogy a benzodiazepinek olyan változatait fejlesztették ki, melyek csak az agy bizonyos helyein található GABAa receptorokhoz kötődnek, jelentősen csökkent az epilepszia gyógyszerek „tompító” hatása, ami komoly életminőség javulást hozott az epilepsziások számára.
A dolog tovább bonyolódik azzal, hogy egy élőlény élete során gyakran megváltozik, hogy sejtjei milyen fehérjéket fejeznek ki (miből építkeznek). Egy embriónak, egy növekvő álaltkának és egy felnőttnek más feladatokat kell megoldani, ehhez az idegsejteknek más szerszámokat (fehérjéket) kell használniuk. Ezért hat például máshogy egy hatóanyag (vagy nem hat) egy gyerekben, mint egy felnőttben.
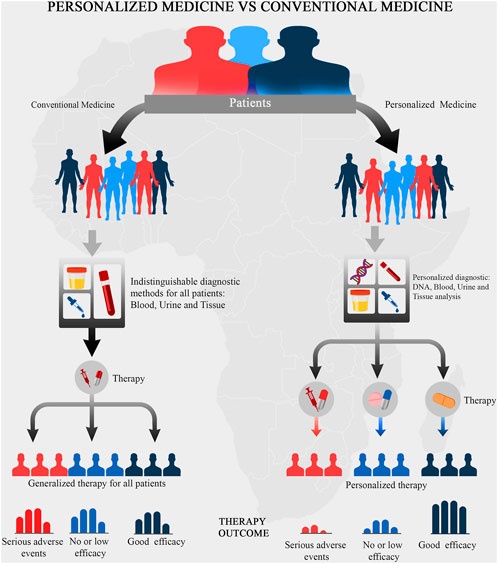
 Az utolsó, az orvosok számára legfájdalmasabb csavar, hogy a mutációknak köszönhetően a számos fehérjeverziónak is számos változatát örökölhetjük szüleinktől (egyet anyánktól, egyet apánktól). Ebből aztán kijöhet az a kavalkád, hogy míg egy gyógyszer 5000 emberben teszi, amit kell, az 5001-dikben nem hat, vagy ne adj’ isten bajokat okoz. Biológusként gyakran intem türelemre ismerőseimet amikor az orvosok hibáiról beszélnek. Könyörgöm, magasan összetett, kiszámíthatatlan biológiai rendszereket próbálnak megjavítani, amelyekben sok minden nem biztos. Még a legjobban képzett leglelkiismeretesebb orvos is belefuthat ilyenekbe. Az egyénekre szabott orvoslás (personalized medicine), mely a genom szekvenálásán és az AI használatán alapul, hatalmas lépésekben fejlődik, és hamarosan sokat segíthet majd az ilyen jellegű problémák kiküszöbölésében. Tudni fogjuk, hogy az adott ember esetében, genetikai hátterének egyedisége miatt, melyik gyógyszer hogyan fog hatni és kölcsönhatni.
Az utolsó, az orvosok számára legfájdalmasabb csavar, hogy a mutációknak köszönhetően a számos fehérjeverziónak is számos változatát örökölhetjük szüleinktől (egyet anyánktól, egyet apánktól). Ebből aztán kijöhet az a kavalkád, hogy míg egy gyógyszer 5000 emberben teszi, amit kell, az 5001-dikben nem hat, vagy ne adj’ isten bajokat okoz. Biológusként gyakran intem türelemre ismerőseimet amikor az orvosok hibáiról beszélnek. Könyörgöm, magasan összetett, kiszámíthatatlan biológiai rendszereket próbálnak megjavítani, amelyekben sok minden nem biztos. Még a legjobban képzett leglelkiismeretesebb orvos is belefuthat ilyenekbe. Az egyénekre szabott orvoslás (personalized medicine), mely a genom szekvenálásán és az AI használatán alapul, hatalmas lépésekben fejlődik, és hamarosan sokat segíthet majd az ilyen jellegű problémák kiküszöbölésében. Tudni fogjuk, hogy az adott ember esetében, genetikai hátterének egyedisége miatt, melyik gyógyszer hogyan fog hatni és kölcsönhatni.
És itt megint előjön a kábítószer-biztonság kérdése. Számos, régóta használt és ezért „biztonságosnak” tekintett kábítószer esetében is bejöhetnek rövidebb vagy hosszabb távon megjelenő egyedi hatások, melyeket a genetikai különbségek okozzák. Nem kell messzire menni. Az alkohol a legtöbb emberben feszültségoldó. De vannak, akik érzelgősek, vannak, akik agresszívak és vannak, akik alkoholisták lesznek tőle. Ugyanígy, kevés ember képes heti 2 szál cigarettát elszívni (mert nem válik függővé), a dohányosok zöme, ha egyszer elkezdte nem tudja abbahagyni. És hát ugye mindkettő tudatmódosító szer a maga módján. Hasonló a dolog például az LSD-vel, vannak, akik hihetetlen kreatívak lesznek tőle, negatív mellékhatások nélkül, de sok esetben élthosszig tartó pszichózisokat okozott a felelőtlen használókban.
A következő bejegyzésben arról lesz szó mitől okoz függőséget egy hatóanyag.
Szerző: Gulyás Attila





