A pajzsmirigyhormon vándorlásáról és a megismerés útjairól
A tudomány művelőit sosem érheti az a meglepetés, hogy munka nélkül maradnak, mert minden kérdésre válaszoltak már, nincs több felfedeznivaló. Gereben Balázs és Fekete Csaba csoportjainak az eLife folyóiratban megjelent munkája egy régi kérdésre adott új és helyes választ, ami ráadásul a transzlációs orvoslásban is hasznosulhat.
Gyakorlatilag már az ókorban is ismerték, de először a középkorban, az alkimistákkal kapcsolatban nevezték meg, Newton a sajátját maga építette. Mi ez? A laboratórium, mely elsősorban a természettudományok területén folyó kutatások elsődleges színhelye, és épp oly sokféle lehet, mint a kutatás maga. A speciálisan felszerelt laboratóriumokra nem csak a kísérletek elvégzése, de szigorúan azonos körülmények között történő megismétlése miatt is szükség van. Amennyiben ugyanis a kísérlet megismétlése nem ugyanazt az eredményt adja, hiteltelen, így bármennyire szenzációs is lenne, nem publikálható.
Egy kutatóintézet laboratóriumaiban sokszor olyan „előmunkálatokat” is el kell végezni, ami a tervezett kísérlet végrehajtását segíti. Ugyanúgy tesznek, mint sok kiváló mesterember vagy művész az ókortól napjainkig. Maguk gyártották szerszámaikat, köveket törtek a festékekhez, székeket, állványokat terveztek azért, hogy elkészüljön egy szobor, festmény, freskó vagy bazilika. A mai kutatók között is vannak, akik összeállítanak egy addig sosem volt mikroszkópot (hárman még Nobel-díjat is nyertek ilyenért), mások számára nélkülözhetetlen egy állatmodell, ezért létrehozzák.
Kiváló példa erre az a pajzsmirigyhormon hatásának mérésére szolgáló THAI (Thyroid Hormone Action Indicator, THAI), szabadalmaztatott transzgenikus egérmodell, melynek segítségével a Gereben Balázs és Fekete Csaba vezette kutatócsoportok tagjai amerikai kollégáik közreműködésével, most fontos felfedezést értek el.
Sokan tudják, hogy a pajzsmirigy igen fontos szervünk, vagy hogy jódhiányos területeken gyakori súlyos betegség volt a golyva, mely a jódozott só használat bevezető országokban gyakorlatilag megszűnt. Gereben Balázs és Fekete Csaba azonban a kevesek közé tartozik, akik ennél sokkal többet tudnak a pajzsmirigyről. Az eLife tudományos folyóiratban megjelent felfedezésük amellett, hogy egy régóta vitatott kérdésre ad magyarázatot, a transzlációs orvoslásban is hasznosul.
(Gereben Balázs és Fekete Csaba kérésére nem nevesítettük az adott kérést megválaszoló személyét, mert a válaszok közös véleményüket tükrözik)
- Mi az, amit mindenkinek jó lenne tudnia, hogy megérthesse a felfedezést és jelentőségét?
- A pajzsmirigy által termelt tiroxin (T4) és a trijódtironin (T3), szervezetünk legtöbb sejtjének fejlődését és működését befolyásoló hormonok, így megfelelő szintjük kritikus az egész szervezet normál működésének fenntartásához. A jelentősen nagyobb mennyiségben termelt T4 egy prohormon, ami nem képes receptorhoz kötődni. E prohormont egy jód lehasításával enzimek alakítják át az aktív T3-má, ami már pajzsmirigyhormon receptorokhoz kötődve fejti ki biológiai hatását.
- Milyen jellemző betegségei vannak a pajzsmirigynek, és változott-e gyakoriságuk?
- A leggyakoribb kórkép a hipotireózis, azaz a pajzsmirigyhormonok hiánya. Ez a betegség sok százmilliós betegcsoportot érint világszerte, pl. csak az USA-ban 30 millió embert! Az ebbe a csoportba tartozó betegek egy részénél a pajzsmirigyet daganat miatt kellett eltávolítani, és így teljes életükben hormonpótlásra szorulnak. Napjainkban a diagnosztizált pajzsmirigydaganatok száma nő. Ennek oka részben az, hogy a diagnosztikai technikák fejlődnek, részben pedig a Covid-időszakban elmaradt vizsgálatok miatt számos daganat csak késve, napjainkban kerül felismerésre.
További jelentős számú betegnél a pajzsmirigy autoimmun gyulladásos betegségei vezetnek a pajzsmirigyhormon hiány kialakulásához. Régebben hipotireózist okozott a jódhiány is, amit szerencsére a jódozott só általános alkalmazása mára szinte eltüntetett.
- Lehet más oka is a hipotireózisnak?
- Ritkább ok lehet a genetikai okokból eredő, veleszületett pajzsmirigyhormon hiány. Az ilyen betegségek korábban súlyos szellemi visszamaradottságot okoztak, de az újszülöttkori szűrésnek köszönhetően ez ma már pajzsmirigyhormon pótlással döntő részben kivédhető.
- Mit kellene tudnunk ahhoz, hogy megérthessük a kutatásotok célját?
- A véráram pajzsmirigyhormon (PMH) szintje viszonylag stabil, míg a különböző szövetekben és sejttípusokban a PMH szint turbulens és gyors változása figyelhető meg. Ez szükséges is ahhoz, hogy megfeleljen a szövetek térben és időben is gyorsan változó PMH igényének. Azt azonban nem tudjuk, hogyan képesek a pajzsmirigyhormonok a stabil keringő vérszint és az előbb említett generális hatások mellett az egyes szövetekre specifikus hatásokat létrehozni.
- És mi az, amit ezzel kapcsolatban ma már „biztosan” tudunk?
-Mára már világossá vált, hogy ezt egy nagyon összetett szövet-, sőt számos esetben sejttípusspecifikus molekuláris szabályozórendszer teszi lehetővé, ami szabályozza a szövetekben a PMH metabolizmusát és hatását. Ez a lokális szabályozó rendszer az agyban különösen nagy jelentőségű. Ezért is közös célunk, hogy felderítsük a PMH hatásának sejttípus specifikus szabályozását végző mechanizmusokat az agyban, és szervezetünk egyéb szöveteiben is.
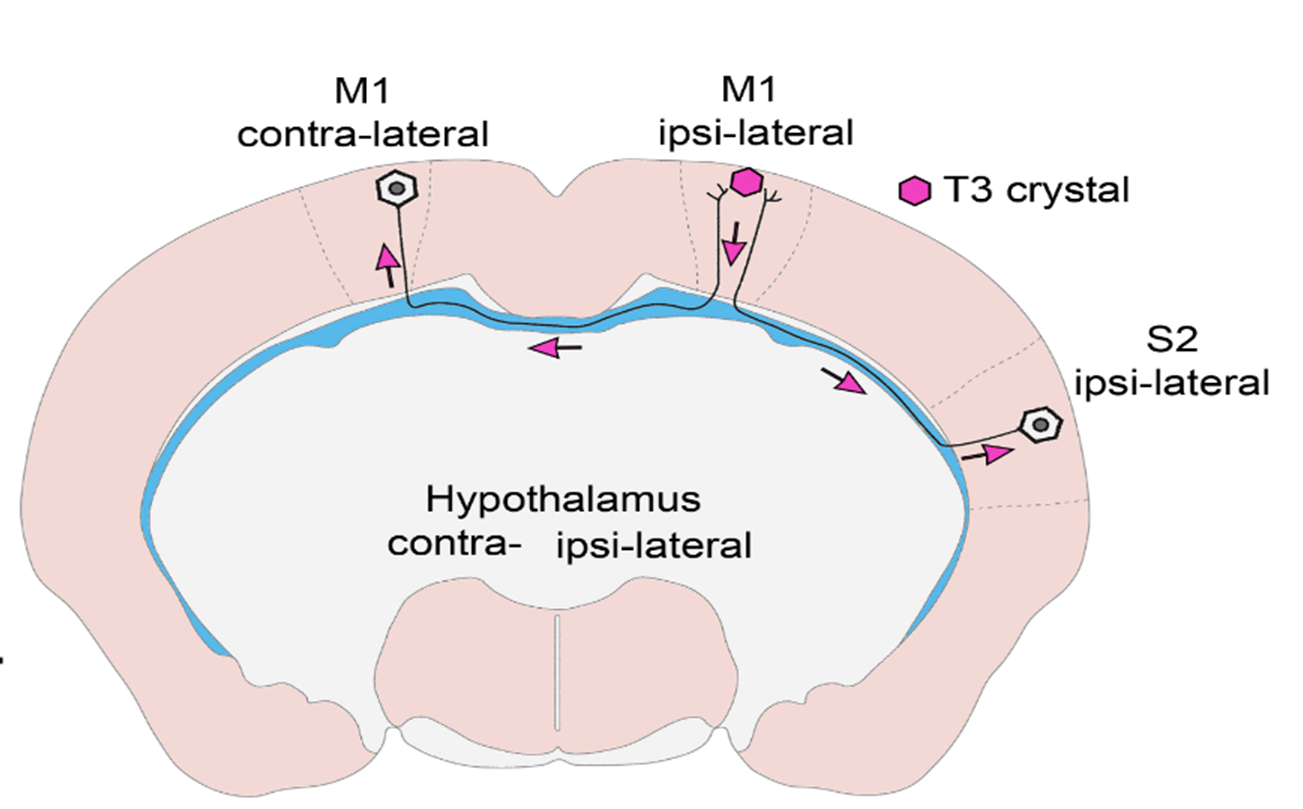
- Mit sikerült eddig kiderítenetek és mi az általatok feltárt új típusú szabályozási mechanizmus?
- In vivo és in vitro kísérletekkel bizonyítottuk, hogy T3 retrográd módon, az idegsejtek axonnyúlványaiban visszafelé utazva éri el az idegsejtek sejtmagját olyan hólyagocskákban vagy más néven vezikulákban, melyek megvédik a hormont az idegsejtekben nagy mennyiségben található T3-bontó enzimtől. Ilyen módon az agykéregben keletkező T3 a hosszú, agyféltekéket összekötő axonokon keresztül a másik oldali agykéregbe is eljuthat, így távol eső agyi régiók szabályozhatják egymás PMH-függő sejtaktivitását! Ez a felismerés egyben segít megválaszolni a szakterület néhány régi, megoldatlan kérdését. Ugyanis bizonyítottuk, hogy a hipotalamusz-hipofízis-pajzsmirigy (HHP) tengelyt szabályozó idegsejtcsoport, azaz a hipotalamusz hipofiziotróp TRH-neuronjai is így kapják a T3-bemenetet a perifériás keringésből és a tanicitákból, a hipotalamusz PMH-aktiváló sejtjeiből.
- Ez miért olyan fontos?
- Ez alapvető jelentőségű, mert ezen alapul az a negatív visszacsatolás, ami biztosítja a vér stabil pajzsmirigyhormon szintjét! Ennek pedig az egész testre van hatása, mivel a TRH-neuronok PMH által kiváltott negatív „feedback” szabályozása a HHP-tengely egyik kulcsfontosságú szabályozási mechanizmusa.
- Kifejezetten ennek a negatív visszacsatolásnak a megmagyarázására terveztétek a kísérleteket, vagy "szerencsétek volt", és rögtön megértettétek a jelentőségét annak, amit mértetek-találtatok?
- Munkánk eredetileg a visszacsatolás jobb megértése céljából indult. A hipotalamusznak ez a régiója régóta különösen érdekel minket, mert itt, de nem egymás közelében helyezkednek el a PMH-által szabályozott TRH idegsejtek, és a pajzsmirigyhormont aktiváló taniciták. Azonban a TRH sejtek axonjai a taniciták nyúlványai közelében találhatók, ami felvetette a lehetőségét, hogy az ezen axonokon belüli pajzsmirigyhormon szállítás lehet a kulcs e kérdés megválaszolásához. A kísérleti eredményeink értelmezésekor jöttünk rá, hogy észleleteink hátterében általánosabb jelenség áll, ezért vizsgálatainkat kiterjesztettük az agykéregre. Kiderült, hogy ez a mechanizmus ott is működik!
- Kísérleteiteket rágcsáló modellben végeztétek, de alaptudományi felismeréseinek értéke mellett van orvostudományi, transzlációs jelentősége is.
- Jelenleg a pajzsmirigyhormon pótlás szinte kizárólag T4 monoterápián alapul. Ez sokakon segít, de az említett hatalmas méretű betegcsoport 10-20%-a számára nem jelent kielégítő megoldást. Számos kezelt hipotireózisos panaszkodik olyan tünetekre, melyek agyi pajzsmirigyhormon hiányra utalnak annak ellenére, hogy a T4 kezelés hatására TSH szintjük a normál tartományban van. A problémát jelentősége ellenére évtizedekig teljesen félresöpörték, csak mostanában kezdtek el foglalkozni azzal, hogy e betegek kezelését hogyan lehetne jobbá tenni.
- Mit jelenthet ez a gyakorlatban?
Az általunk feltárt mechanizmus, ami megvédi az axonokban szállított T3-at az idegsejtekben is termelt pajzsmirigyhormon bontó enzimtől, feloldja azt a paradoxont, hogy a hipotireózis T4 monoterápiájára rosszul reagáló egyes betegek jobban érzik magukat T4+T3 kombinációs terápia esetében annak ellenére, hogy az agyban nagyon jelentős T3 bontó kapacitás van. Most már tudjuk, hogy a T3 védett vándorlása miatt képes arra, hogy hatását kifejtse, így jelen adataink hozzájárulnak az alternatívát jelentő T4+T3 kombinációs terápia hatásmechanizmusának megértéséhez.
Az is reményre adhat okot, hogy előrehaladott fázisban lévő, a jelen közleményben még nem szereplő, de a közölt vizsgálatok folytatásaként elért újabb eredményeink még közelebb fognak vinni minket az említett betegcsoport tüneteinek megértéséhez.
: Axonal T3 uptake and transport can trigger thyroid hormone signaling in the brain. May 19, 2023 https://doi.org/10.7554/eLife.82683
Kittel Ágnes