Technikai: A Hebb szabály molekuláris mechanizmusai
Mi is történt a Lømo és Bliss kísérletben? Egy, a memória kialakulásában fontos szerepet játszó agyterületből, a hippokampuszból vágtak ki a kutatók egy szeletet patkány agyából. Ezt a kb. fél milliméter vastag és 4x4 milliméter méretű szeletet egy apró kis kamrában, a megfelelő hőmérséklet, oxigéntartalom és tápanyagellátás biztosításával közel fél napig életben lehet tartani. Az idegsejtek továbbra is ketyegnek és beszélgetnek egymással és az agyszeletben megközelíthetők finom hegyű üvegelektródákkal, hogy elektromos aktivitásuk követhető legyen.
A kísérletben a hippokampusz CA1 nevű területén található piramissejtek (a területre jellemző serkentő sejtek) aktivitását mérték, miközben a rájuk érkező pályarendszert, a magyar neuroanatómus Schaffer Károly által leírt, Schaffer kollaterálisokat (egy másik terület a CA3 piramissejtjeinek axonjait) ingerelték elektromosan.
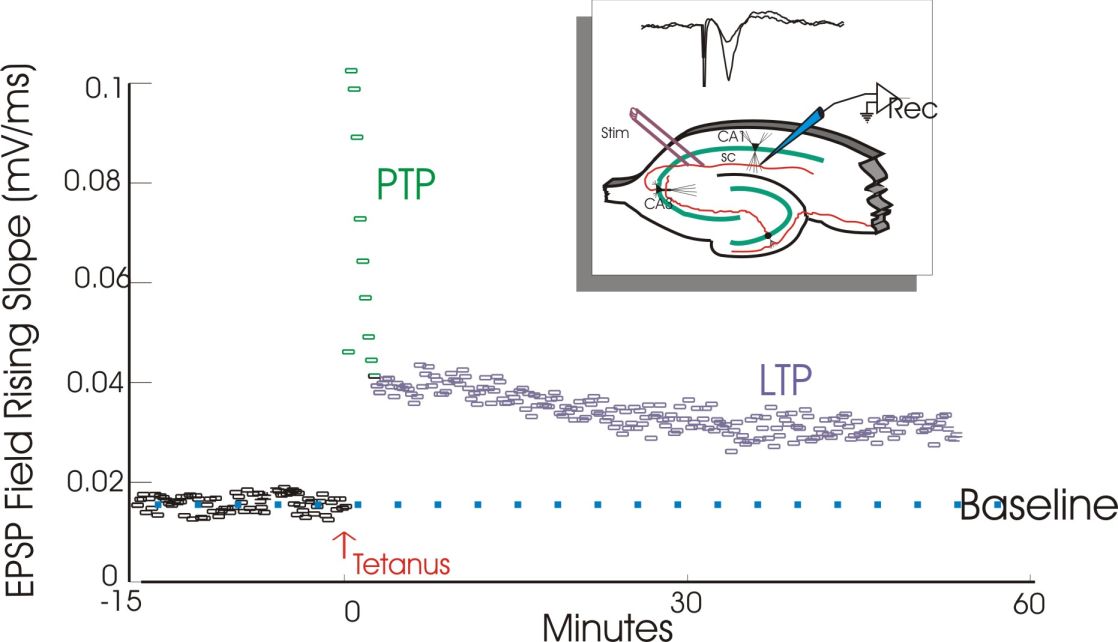 Kezdeti kísérleteikben a sejtek nagy csoportjának aktivitását figyelték meg EEG elektródával és a kiváltott serkentő potenciál (populációs excitatory postsynaptic potential, EPSP) meredekségét mérték. A mechanizmus felderítésének majd 25 éve alatt a mérésket egy idő után már egyedi idegsejtekből sejten belülre helyezett (intracelluláris) elektródával mérték. Ez kicsit trükkösebb feladat, de erősebb jelet ad és lehetőség van a sejtműködés megfelelő befolyásolására is.
Kezdeti kísérleteikben a sejtek nagy csoportjának aktivitását figyelték meg EEG elektródával és a kiváltott serkentő potenciál (populációs excitatory postsynaptic potential, EPSP) meredekségét mérték. A mechanizmus felderítésének majd 25 éve alatt a mérésket egy idő után már egyedi idegsejtekből sejten belülre helyezett (intracelluláris) elektródával mérték. Ez kicsit trükkösebb feladat, de erősebb jelet ad és lehetőség van a sejtműködés megfelelő befolyásolására is.
Ritka és gyenge impulzusok megmérték a válasz nagyságát (ez a teszt stimulálás), melynek mérete állandónak bizonyult. Egy nagy frekvenciás vagy erős ingerlést követően, a kiváltott válasz nagysága (amplitúdója) a korábbi tesztimpulzus hatásához képest többszörösére (4-5x) nőtt, majd viszonylag hamar lecsengett, de tartósan 1,5-2 szerese maradt az eredeti válaszerősségnek. A korai, átmeneti erős fázist post-tetanic potentiation-nek (PPT), azaz tetanikus ingerlést követő erősödésnek hívják. A második fázist és az egész folyamatot LTP-nek nevezik (lásd fentebb). A tartós hatás a szelet esetében 1 óra volt (tovább nem lehet fenntartani a preparátumot), de később ugyanezen az agyterületen élő, viselkedő állatban is elvégezték a kísérletet, és napok, hetek múlva is megmaradt a változás.
A következő lépésben gyógyszertani (farmakológiai) vizsgálatokkal azt próbálták kideríteni milyen átvivőanyag receptorok és milyen sejten belüli jelátvivő rendszerek játszhatnak szerepet a folyamatban.A gyógyszertan, farmakológia azt vizsgálja, hogy különböző természetes és mesterséges vegyületek milyen hatással vannak a szervezet, illetve ebben az esetben az idegrendszer működésér. A farmakológia gyökerei a sámánokig, törzsi varázslókig és javasasszonyokig nyúlnak vissza, akik az évezredek alatt megfigyelték, hogy bizonyos növényekből, gombákból és ritkábban állatokból vagy azok részeiből gyógyhatású, vagy/és mérgező főzetek készíthetők. Ami persze nem véletlen, hiszen mivel a növények nem tudnak elszaladni ezért ravasz, elsősorban az idegrendszerre ható mérgeket termelnek védekezésként. Ők ezt a tudást továbbfejlesztették egyéni megfigyelésekkel és továbbadták utódaiknak. A középkorban a katolikus egyház tűzzel vassal irtotta ezeket a „pogány” gyógyítókat, de szerencsére ugyanezen egyház szerzetesei a kolostorokban sok tudást átmentettek füveskönyvek formájában. Innen került aztán a kialakuló tudományba, hogy melyik természetes gyógyszer mire jó. A kémia tudománnyá válásával a tudósok is felismerték, hogy a természetes készítmények meghatározott anyagokat vagy anyagkombinációkat tartalmaznak, és kémiai szétválasztási eljárásokkal számos gyógyhatású anyagot különítettek el. Ezekről kezdetben nem lehetett tudni, hogy hogyan és hol hatnak, de kémiai szerkezetük ismertté vált. Idővel aztán hosszú kísérletsorozatokban tisztázták, hogy egy-egy anyag melyik szervben és hogyan hat, majd sok esetben azt is tisztázták pontosan milyen molekulák működését befolyásolják.
A farmakológiai hatóanyagok alapjában két módon hathatnak: 1) vagy hozzákötődnek a molekulának ahhoz a részéhez, amellyel funkcióját ellátja - például egy speciális kémiai átalakulást elősegítő fehérje (katalizátor, enzim) kötőhelyéhez – és ezáltal gátolják vagy ritkábban aktivált állapotban tartják azt. Illetve, 2) a molekula olyan részéhez kapcsolódnak, hogy ezáltal a molekula eredeti funkcióját megváltoztatják, hatását csökkentik vagy növelik.
A funkciót gátló hatású molekulákat antagonistának, a serkentő hatásúakat agonistáknak, a működést megváltoztatókat pedig modulátoroknak hívjuk. Ezek a molekulák gyakran hasonló szerkezetűek a szervezetben eredetileg használt molekulákhoz, de gyakran előfordul, hogy kémiai felépítésük jelentősen eltér. Azért hatásosak mégis, mert nem a pontos felépítés számít, hanem hogy a molekula felszínén van-e olyan 3D részlet amelyik hozzá tud kapcsolódni a befolyásolandó molekula megfelelő helyéhez. Hogy milyen alakú a kulcstartó az ugye nem befolyásolja, hogy mit nyit a kulcs. Idővel az is kiderült, hogy egy-egy szervezetben előforduló jelátvivő molekula többféle jelfelfogó receptorhoz is hozzákötődhet és hogy a mesterséges molekulák nem minden receptortípushoz illeszkednek. Ha például nagyon nagy a kulcstartónk, akkor a sarokszekrényhez nem tudunk hozzáférni a kulcsunkkal.
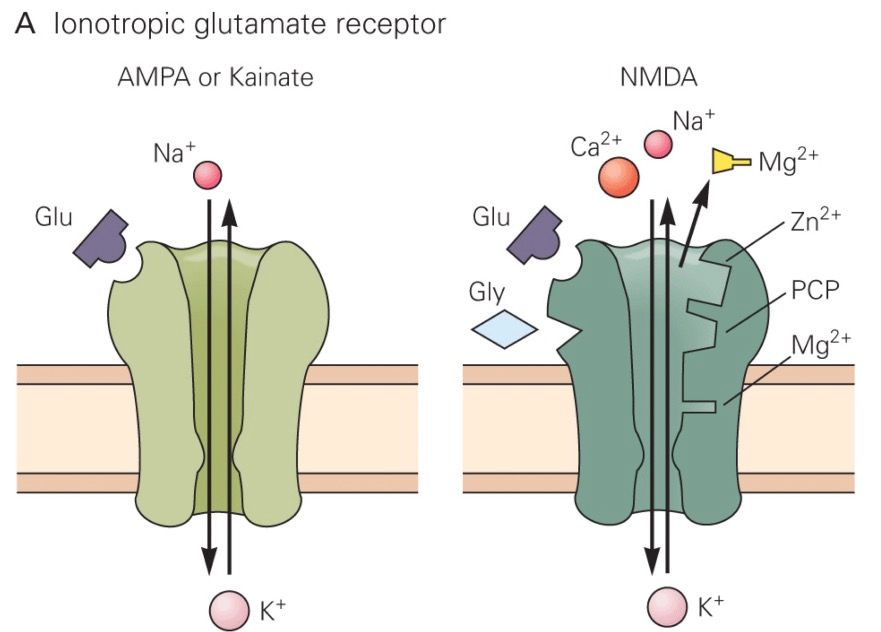
Az agykérgi serkentő sejtek közötti ingerületátvitelt a glutamát nevű aminosav végzi. Történetünk szempontjából itt két glutamát receptort kell megkülönböztetnünk. A glutamát mindkettőt aktiválja, de egy AMPA nevű anyaggal csak az egyik csoport aktiválható (AMPA receptor), egy NMDA nevű anyaggal pedig egy másik (NMDA receptor). Olyan anyagokat is találtak, amelyek igen válogatósan csak az egyik vagy csak a másik receptor típus esetében képesek megakadályozni a glutamát hatását, azaz az adott receptor típuson keresztül zajló információátvitelt lekapcsolni. Ezen anyagok használatakor kiderült, hogy az egyes glutamát receptorok más módon hatnak a sejtekben.
Huhh, végre eljutottunk odáig, hogy a szinapszis szintű tanulást elmagyarázhassam.
A fenti kísérletekben azt találták, hogy amikor az AMPA receptorokat a megfelelő antagonistával gátolják, akkor a tesztimpulzusokkal korábban kiváltott serkentő áramok nagyrészt eltűnnek, jelentősen csökken a jelátvitel. Az NMDA receptorok gátlásának azonban más volt a hatása, attól függően a kísérlet melyik fázisában adták. Ha az NMDA receptorokat az LTP kialakításához szükséges erős stimulálás alatt gátolják, akkor nem figyelhető meg a hosszútávú hatásnövekedés. Ha az NMDA receptorokat ez előtt vagy ez után gátolták akkor a kiváltott válaszok a gátlás alatt valamivel kisebbek lesznek, de az ingerületátvitel megmarad. Ha az LTP már egyszer kialakult akkor az NMDA receptor gátlása nem okozott változást a megnövekedett válaszban (csak minimális csökkenést a gátlás idejére). Tehát az NMDA receptor a tanuláshoz kell, az AMPA receptor pedig a jelátvitelhez, mind a kezdeti, mind a megerősödött állapotban. Közel 10 év munkával számos kutatócsoport kibogarászta mi is történik pontosan.
Az AMPA receptor egy viszonylag egyszerű szerkezet, ha glutamát kerül a kötőhelyére kinyílik, elsősorban Na+ ionokat enged a sejtbe, ezáltal annak belseje pozitívabbá válik, serkentődik. Ha kevés AMPA receptor van a szinapszis túloldalán a dendriten, akkor az axonterminálisból a szinaptikus résbe ömlő glutamát kevés AMPA receptort nyit és kicsi lesz a jel, a szinapszis gyenge. Ha sok az AMPA receptor akkor a kiváltott elektromos jel nagy, a szinapszis hatékonyan adja tovább az ingerületet. Érdekes adalék: egy nagyobb szinapszisban több AMPA receptor fér el, ezért erősebb posztszinaptikus áramot vált ki. Azaz elektron mikroszkópban becsülhető az egyes szinapszisok erőssége!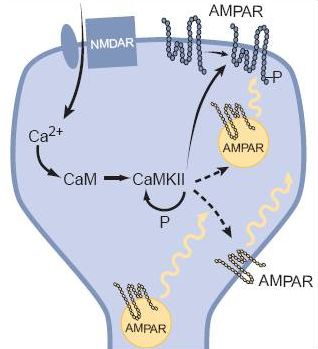 Az NMDA receptor egy bonyolultabb szerkezet. Neki két jel is kell ahhoz, hogy kinyisson. Az nem elég neki, hogy glutamáthoz jut, az ionok sejtbe eresztéséhez az is kell, hogy a dendrit, amin ül depolarizált legyen. A glutamát jelenléte ugye azt jelzi, hogy a beérkező axon aktív volt, azaz az információt küldő sejt aktív. A depolarizált dendrit azt jelzi, hogy a posztszinaptikus sejt már kapott elég serkentést és ő maga is aktív. Az NMDA receptor tehát csak akkor nyit, amikor a preszinaptikus sejt ÉS a posztszinaptikus sejt is aktív (a két sejt egyszerre). Azaz az NMDA receptor egy logikai ÉS kapu. Másik jellegzetessége, hogy a Na+ ionokon kívül Ca2+ ionokat is beenged a sejtbe, és ezáltal egy bonyolult eseményláncolatot indít meg, melynek eredménye az, hogy a társítást (mindkét sejt aktiválódását) követően további AMPA receptorok épülnek be a dendritbe, megnövelve ezáltal a szinaptikus átvitel hatékonyságát.
Az NMDA receptor egy bonyolultabb szerkezet. Neki két jel is kell ahhoz, hogy kinyisson. Az nem elég neki, hogy glutamáthoz jut, az ionok sejtbe eresztéséhez az is kell, hogy a dendrit, amin ül depolarizált legyen. A glutamát jelenléte ugye azt jelzi, hogy a beérkező axon aktív volt, azaz az információt küldő sejt aktív. A depolarizált dendrit azt jelzi, hogy a posztszinaptikus sejt már kapott elég serkentést és ő maga is aktív. Az NMDA receptor tehát csak akkor nyit, amikor a preszinaptikus sejt ÉS a posztszinaptikus sejt is aktív (a két sejt egyszerre). Azaz az NMDA receptor egy logikai ÉS kapu. Másik jellegzetessége, hogy a Na+ ionokon kívül Ca2+ ionokat is beenged a sejtbe, és ezáltal egy bonyolult eseményláncolatot indít meg, melynek eredménye az, hogy a társítást (mindkét sejt aktiválódását) követően további AMPA receptorok épülnek be a dendritbe, megnövelve ezáltal a szinaptikus átvitel hatékonyságát.
A Hebb szabály molekuláris szintű megvalósításáért tehát az NMDA receptorok a felelősek!
Aki bírja még a technikai részleteket annak bemutatunk még néhány idegsejt trükköt. A későbbiekben majd kifejtjük, hogy az idegsejtek aktivitásszintjének jól meghatározott határok között kell maradnia. Ha a sejteken a tanulás során minden szinapszis súlya csak felfelé módosulna akkor egy idő után a sejtek összes bemenete nagyon erős lenne, a sejtek nagyon könnyen aktiválódnának, ami lerontaná a jelfeldolgozást, a memóriatárolást és epilepsziás rohamok kialakulásához vezetne. Ennek elkerülésére egy ravasz folyamat azt eredményezi, hogy amikor a sejt Hebb szabály szerint erősödő szinapszisai erősödnek, az éppen nem megerősödő szinapszisok kicsit gyengülnek.
Ehhez a sejtek két dolgot fejlesztettek. Egyrészt a serkentő sejtekre érkező bemenetek nem közvetlenül a dendritre érkeznek, hanem a dendritekről gombakalap-szerűen kitüremkedő nyúlványokra, az úgynevezett dendrittüskékre. A szinapszisok az AMPA és NMDA receptorokkal a tüske fején találhatók. Amikor az NMDA receptor Ca2+-t enged be akkor a tüskefejben magas lesz a Ca2+ koncentrációja és beindítja az AMPA receptorok szinapszisba épülését. A fej egy vékony szárral kapcsolódik a dendrithez, amelyen keresztül az elektromos jel leterjed, de a szűk nyak megakadályozza a Ca2+ ionok diffúzióját, a tüskefejbe szorítja nagy részüket, ezzel a tanulást az adott tüskére korlátozza. A másik trükk, hogy míg a magas Ca2+ szint további AMPA receptor beépülést és szinaptikus súly növekedést okoz, kis mennyiségű Ca2+ jelenléte ennek fordítottját okozza. A tüskenyakon kiszivárgó kevéske Ca2+ eljut a szomszédos tüskékbe, ahol az alacsony Ca2+ szint nem szinaptikus súly erősödést, hanem a szinaptikus súly kismértékű gyengülését váltja ki. Tehát ha egy sejt aktív, aktiválódott és ezáltal súlyát növelő szinapszisa közelében minden inaktív szinapszis erőssége kicsit csökken. Az ilyesmit hívják a matematikusok és a fizikusok renormalizációnak. Ugye itt az történik, hogy ha egy súly erősen nő a többi kicsit csökken, azaz a sejt szinaptikus bemeneteinek összege nagyjából állandó marad. Ennek a mechanizmusnak a jótékony hatása az, hogy agyműködésünk a biztonságos tartományban marad. Hátránya az, hogy amikor új emléknyomaink alakulnak ki, a régiek halványodnak… Agyunk úgy felejt, hogy az az emléknyom, amit nem frissítünk lassan kikopik.
Ezt a folyamatot kísérletesen is meg lehet figyelni. Az LTP folyamat ellentéteként és LTD-nek (long-termdepression-nek, azaz hosszútávú csökkenésnek hívják). Az LTP kísérlethez hasonlóan a teszt impulzusok után ha kicsit emelt frekvenciával, vagy nagyon sokat adnak gyenge impulzusokat, akkor a kapcsolat erőssége tartósan csökken. Ugye itt az történik, hogy a bemenet aktív glutamát szabadul fel, de a sejt csak egy picit depolarizálódik, anélkül, hogy kisülne. Ennek hatására egy kevés Ca2+ jelenik meg a sejt belsejében és megindul a szinaptikus súly csökkenése, hiszen nem volt korreláció a bemenet és a sejt kisülése között. Ennek kicsit más a molekuláris mechanizmusa mint az LTP nek, de végeredményként itt is az AMPA receptorok száma változik meg, értelem szerűen kevesebb lesz a szinapszisban. Hogy LTD is létezik annak természetesen a matematikusok örülnek, mivel így teljes a szinaptikus súlyváltozást leíró egyenlet. Nem csak pozitív, de negatív irány is van.
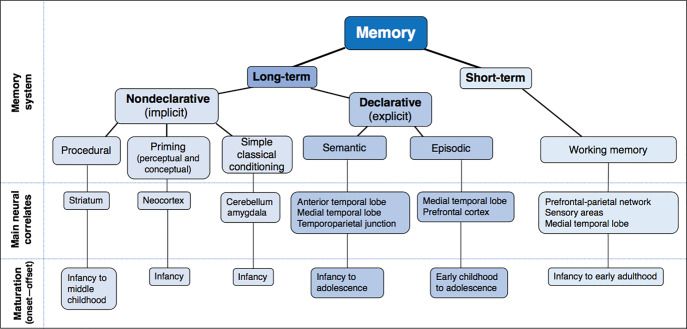 A tanulás azonban nem csak ennyi. Itt csak annak a mechanizmusát mutattuk be, hogy egy egyszerű idegsejthálózatban hogyan történik a tanulás. Az emberi agyban ez csak egy alapelem, valójában sokkal bonyolultabb a tanulás. Egyrészt több különböző típusú tanulás és memória van (személyes emlékek kialakulása, mozdulatok és tények megtanulása), melyek eltérő agyi rendszereket vesznek igénybe. Másrészt az agy nem tanul meg mindent, hanem csak azt, amit megfelelő rendszerei éppen fontosnak tartanak. Ezekről a finomságokról majd az agyi területek szerveződésének a szintjén beszélünk.
A tanulás azonban nem csak ennyi. Itt csak annak a mechanizmusát mutattuk be, hogy egy egyszerű idegsejthálózatban hogyan történik a tanulás. Az emberi agyban ez csak egy alapelem, valójában sokkal bonyolultabb a tanulás. Egyrészt több különböző típusú tanulás és memória van (személyes emlékek kialakulása, mozdulatok és tények megtanulása), melyek eltérő agyi rendszereket vesznek igénybe. Másrészt az agy nem tanul meg mindent, hanem csak azt, amit megfelelő rendszerei éppen fontosnak tartanak. Ezekről a finomságokról majd az agyi területek szerveződésének a szintjén beszélünk.
Szerző: Gulyás Attila





