Az idegsejtek működésének hangolása II: A jelösszegződés finomhangolásának módjai
Ahhoz, hogy megérthessük a nem-szinaptikus jelátvitel miért fontos a jelfeldolgozásban, el kell engednünk még egy egész csordára való bestiát, mégpedig beszélnünk kell néhány további átvivőanyagról, amiket az idegrendszer bonyolódása bejegyzésben említettünk, a sejthártyában található különböző receptorok és ioncsatornák családjairól, ezek kölcsönhatásáról és a sejtek működésének hangolásában betöltött szerepükről.
Kezdjük a szinaptikus és nem szinaptikus átvitel sajátosságaival. A szinaptikus átvitelben ható klasszikus gyors transzmitterek, mint, pl. glutamát és GABA gyorsan (1-4 msec) és kis távolságon (~1 µm) dolgoznak, mivel a szinaptikus résbe szabadulnak fel, ahol koncentrációjuk nagy marad. Az axonterminálisból a sejtek közötti térbe, vagy a szinapszisból kiszabaduló moduláló jellegű átvivőanyagok (acetil-kolin, szerotonin, noradrenalin stb.), mivel messzebb és nagyobb térrészbe jutnak el (~5-50 µm) lassabban hatnak és alacsonyabb koncentrációban vannak jelen (az anyagok egy része mindkét módon hathat). A két esetben a hatást más típusú receptorok közvetítik. A gyors esetben a receptorok egyben ioncsatornák is (ionotróp receptorok), azaz az anyag kötésekor rájuk jellemző arányban engedik be az idegsejtek membránpotenciálját meghatározó ionokat, hiszen a leggyorsabban elektromos áram útján lehet egy idegsejtet befolyásolni. Ilyen receptor két korábbi ismerősünk a glutamát AMPA receptora és a GABA A receptora. A lassú receptorok maguk nem ioncsatornák, hanem valamilyen módon a sejtek belső jelátviteli rendszerére (másodlagos hírvivő rendszer) kapcsolódnak rá (metabotróp receptorok) és közvetve, lassan, elnyúlóan (50-200 msec vagy akár percek) kapcsolhatnak be/ki egy vagy akár több fehérjét, amelyek ioncsatornaként működve megváltoztatják a sejtek membránpotenciálját és elektronikus tulajdonságait. A dolgot tovább cifrázza, hogy egyetlen, a sejt membránfolyamataiban szerepet játszó fehérjét nem csak egy, hanem több jelátviteli rendszer is befolyásolhatja, akár ellentétes irányokba is. Ezért a metabotróp receptorok, másodlagos hírvivő rendszerek és az általuk befolyásolt fehérjék egy bonyolultan kölcsönható szabályozó hálózatot alkotnak.
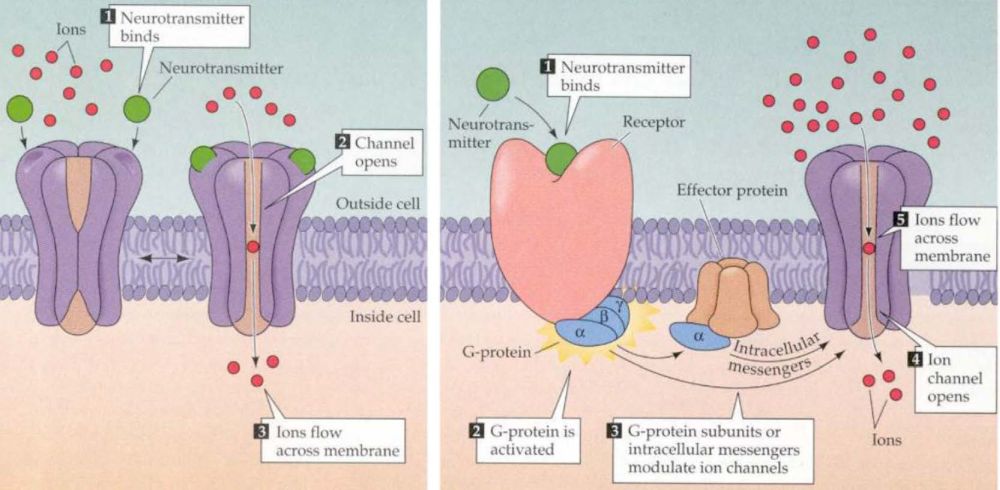
A glutamátnak több eltérő típusú metabotróp receptora is van (mGluR 1-5ig), melyek eltérő másodlagos sejt jelátvivő rendszerekhez kapcsolódhatnak és a célsejtek eltérő részein elhelyezkedve eltérő, akár ellentétes hatásokat is kifejthetnek. A GABA B receptora is ilyen, ha ez aktiválódik, a felszabadított másodlagos hírvivő anyagok hatására az idegsejt hártyájában egy K+ csatorna nyílik meg és a sejtből kiáramló K+ áram a sejtet hiperpolarizálva annak aktivitását csökkenti. Míg az ionotróp receptorok majdnem mindig a szinapszisban a posztszinaptikus oldalon találhatók, a metabotróp receptorok a szinapszis szélén, a szinapszison kívül, de még az axonon is előfordulhatnak. Például, mind a GABA-nak mind a glutamátnak található metabotróp receptora legtöbb axonterminálison, melyek aktivációja csökkenti a további axon-terminális aktiválódást és ezért negatív visszacsatolással képes szabályozni a túlzott ingerületátvivő anyag felszabadulást.
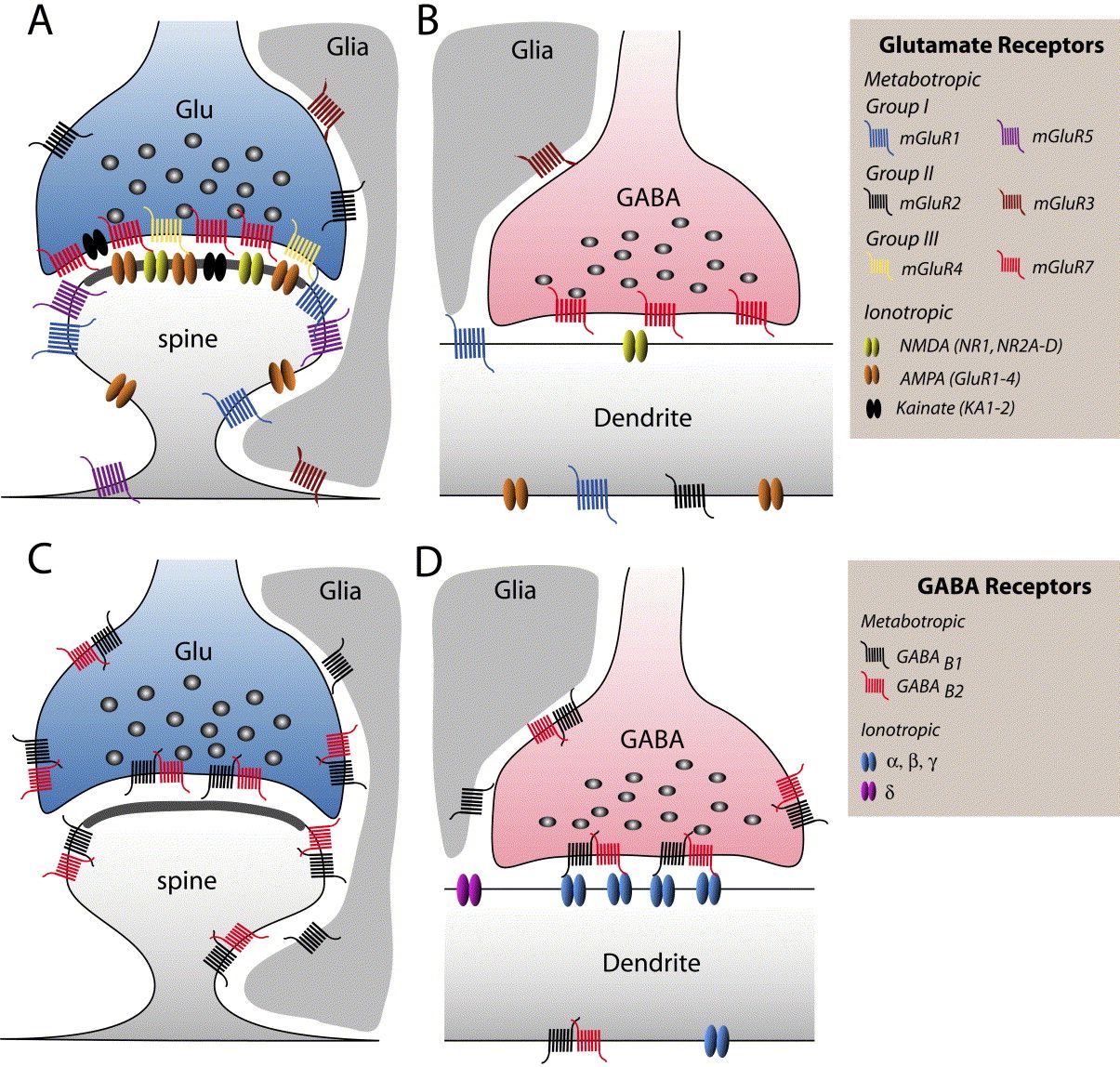
A két receptorcsalád között még egy jelentős különbség van, a gyors receptorok csak akkor nyílnak ki, ha az ingerületátvivő anyaggal nagy töménységben találkoznak (hiszen a szinapszisba ömölve az átvivőanyagok koncentrációja magas). A metabotróp receptorokra viszont már alacsony koncentrációban is hatásos egy átvivőanyag (hiszen a szövetben szétterjedve kihígul). Bár finomabb jeleket érzékelnek, hatásuk nem gyengébb, hiszen a sejt belső jelátvivő rendszerei felerősítik. Hatásuk, mint írtuk lassú, elhúzódó, hangolják a sejtek jelfeldolgozó képességét.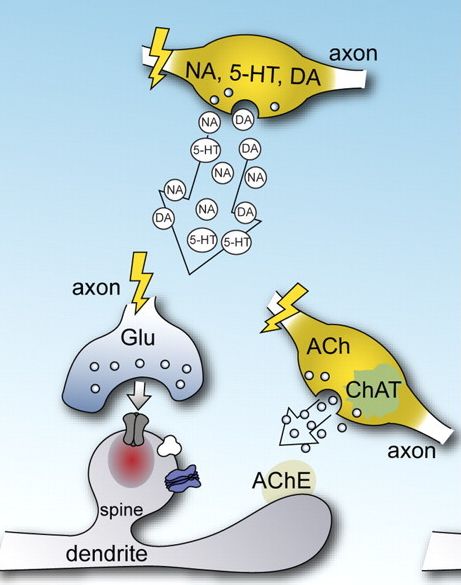 Mivel a nem-szinaptikus kommunikációban nem szigorúan célzott a sejtek közötti jelátvitel, fontos abban, hogy eltérő ingerületátvivő anyagokat használó agyi rendszerek együttműködjenek. Ez az agyi jelfeldolgozás újabb lehetőségét nyitja meg, mert például az agykéreg alatti, a szervezet homeosztázisát biztosító agyterületek eltérő transzmittereket használó sejtjeiből felszabadító anyagok (szerotonin, dopamin, adrenalin) a nem-szinaptikus kölcsönhatások útján is egyfajta kölcsönhatási hálóba lépnek.
Mivel a nem-szinaptikus kommunikációban nem szigorúan célzott a sejtek közötti jelátvitel, fontos abban, hogy eltérő ingerületátvivő anyagokat használó agyi rendszerek együttműködjenek. Ez az agyi jelfeldolgozás újabb lehetőségét nyitja meg, mert például az agykéreg alatti, a szervezet homeosztázisát biztosító agyterületek eltérő transzmittereket használó sejtjeiből felszabadító anyagok (szerotonin, dopamin, adrenalin) a nem-szinaptikus kölcsönhatások útján is egyfajta kölcsönhatási hálóba lépnek.
Az utolsó csavarok vannak hátra. Sok transzmitter gyorsan és lassan is tud hatni (akár ugyanabból az axonterminálisból felszabadulva). De ezt ugye már ki lehetet találni abból, hogy az alap, gyors transzmittereknek: a glutamátnak és a GABAnak is van ionotróp és metabotróp receptora. De fogadok azt senki nem találta ki, hogy vannak olyan idegsejtek, amiknek az axonjából egyszerre többféle (gyors és lassú hatású) transzmitter is felszabadul.
Nézzük meg hogyan mire is ez a nagy hajcihő? Milyen sejtfunkciókat befolyásolhatnak a moduláló jellegű, metabotróp receptorokon keresztül ható ingerületátvivő anyagok.
A sejtek nyugalmi, valamint az ingerületterjedés és jelösszegzés során változó membránpotenciálját számos Na-csatorna család, de még fontosabban, különböző K és Ca csatorna családok állítják be. Vannak olyan K és Ca csatornák, amelyek feszültség függőek, azaz a membránpotenciál változásának hatására nyílnak vagy záródnak. Eltérő típusaik más feszültségszintre és hosszabb vagy rövidebb idő eltelte után reagálnak. De olyan K és Ca csatornák is vannak, amelyek a másik ion koncentrációjának
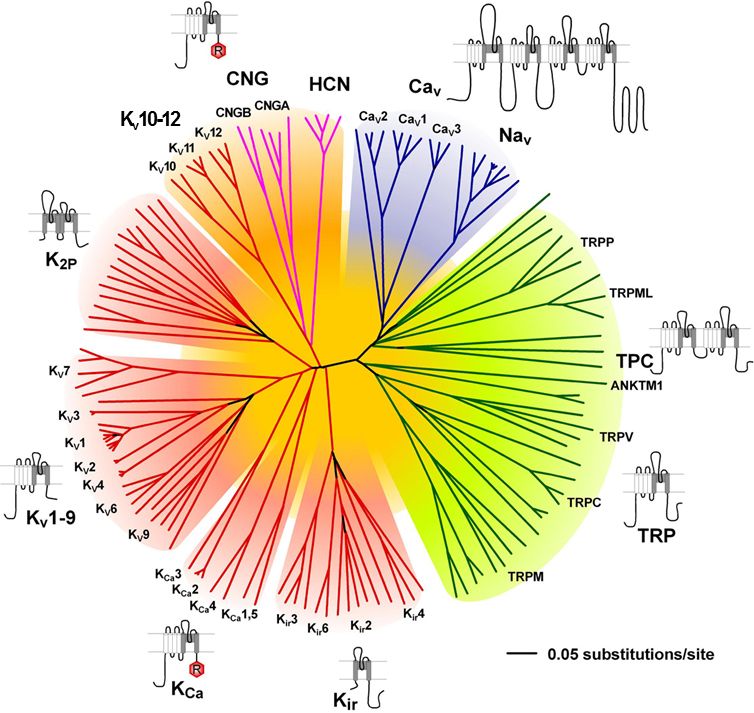
megváltozásakor nyílnak vagy csukódnak. Itt most nem megyünk bele a részletekbe, hogy hogyan, de a megfelelő helyre, megfelelő keverékben elhelyezett csatornák képesek jelentősen megváltoztatni a sejtek jelfeldolgozó tulajdonságait. A K csatornák fontos szerepet játszanak a sejtek nyugalmi potenciáljának beállításában, azaz meghatározzák egy sejt mennyire aktiválható és mennyi serkentő bemenetet kell kapjon ahhoz, hogy kisüljön. A Ca csatornák a jelösszegzésben, jelerősítésben és a jelek kölcsönhatásában játszanak elsősorban szerepet. A K, Ca és Na csatornák összjátékából alakul ki, hogy egy sejt mikor aktiválódik, illetve az aktiválódott sejt milyen mintázatban és mennyi akciós potenciált bocsájt ki magából. Más csatornakombinációval ellátott sejtek (melyeket a genetikai program és a hálózatban való elhelyezkedésük formált) más módon összegzik a jeleket.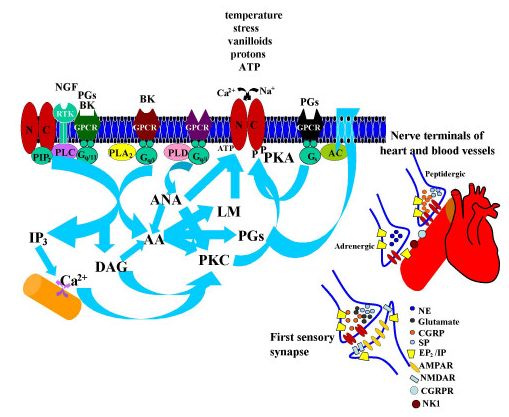 És itt jön a hangolás (moduláció). A metabotróp receptorok által ki vagy bekapcsolt másodlagos hírvivő rendszerek molekulái képesek arra, hogy a csatornák megfelelő részeihez kapcsolódva megváltoztassák azok tulajdonságait és ezáltal a sejtek jelfeldolgozását, jelkibocsájtásának ritmusát. Mivel számos moduláló rendszer (szerotonin, dopamin, noradrenalin, hisztamin) mindegyike több metabotróp receptoron hat, ezek pedig több, egymással kölcsönható, másodlagos hírvivő rendszeren keresztül eltérő típusú ioncsatornákat ez egy igen sokodalú, kifinomult mechanizmus. Ezt a hálózatot is tekinthetjük egyfajta jelfeldolgozásnak és bizonyára sokat csizolta az evolúció, hogy mindenki-mindenkivel a túléléshez leghatékonyabb módon hasson kölcsön.
És itt jön a hangolás (moduláció). A metabotróp receptorok által ki vagy bekapcsolt másodlagos hírvivő rendszerek molekulái képesek arra, hogy a csatornák megfelelő részeihez kapcsolódva megváltoztassák azok tulajdonságait és ezáltal a sejtek jelfeldolgozását, jelkibocsájtásának ritmusát. Mivel számos moduláló rendszer (szerotonin, dopamin, noradrenalin, hisztamin) mindegyike több metabotróp receptoron hat, ezek pedig több, egymással kölcsönható, másodlagos hírvivő rendszeren keresztül eltérő típusú ioncsatornákat ez egy igen sokodalú, kifinomult mechanizmus. Ezt a hálózatot is tekinthetjük egyfajta jelfeldolgozásnak és bizonyára sokat csizolta az evolúció, hogy mindenki-mindenkivel a túléléshez leghatékonyabb módon hasson kölcsön.
Egy példa: amikor egy állat a környezetében valami fontos dologgal találkozik egyik kéreg alatti területéről (bazális előagy) acetil-kolin szabadul fel. Az acetil-kolin többféle receptoron keresztül a másodlagos hírvivő rendszerek útján a sejtek dendritjein, sejttestén és axonterminálisaiban számos K csatorna működését megváltoztatja. Ezáltal a sejtek serkenthetőbbé válnak, könnyebben kisülnek ugyanarra a beérkező jelmennyiségre. Igaz közben axonterminálisaikból kisebb valószínűséggel szabadulnak fel a transzmitterek, azaz a jelátvitel erőssége csökken. Az acetil-kolinnak a sejtek jelintegrációjára és jelátvitelére gyakorolt hatásának eredményeképpen megváltozik az agy aktivitásának mintázata.

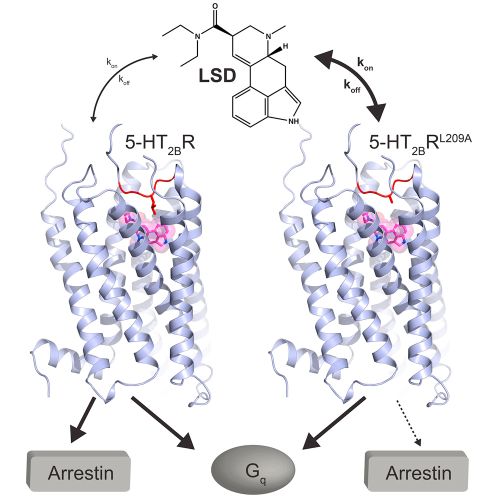 Egy izgalmasabb példa az LSD hatása. Az LSD a szerotionin (5-HT) egyik receptorán hat és a gátlósejtek K csatornáit hangolja. Hatására a gátlósejtek kicsit gyengébben ellenőrzik a hálózat aktivitását. Mivel ebből a receptorból a látókéregben van a legtöbb LSD hatására a látórendszer kicsit túlreagál és a Google Deep Dreeaming-hez hasonló képeket láttat.
Egy izgalmasabb példa az LSD hatása. Az LSD a szerotionin (5-HT) egyik receptorán hat és a gátlósejtek K csatornáit hangolja. Hatására a gátlósejtek kicsit gyengébben ellenőrzik a hálózat aktivitását. Mivel ebből a receptorból a látókéregben van a legtöbb LSD hatására a látórendszer kicsit túlreagál és a Google Deep Dreeaming-hez hasonló képeket láttat.
Az idegsejtek modulációja ahhoz hasonlít, mint amikor számítógépünk energiatakarékos üzemmódba kapcsol, mert akkumulátorának töltöttségi szintje a beállított szint alá esik. Ilyenkor „felszabadul” egy üzenet az operációs rendszerben, melynek hatására gépünk lekapcsolja a Bluetooth és WiFi kapcsolatokat, csökkenti a képernyő megvilágítás erősségét és nem végez olyan háttérfeladatokat, amik a processzort az aktuális szükséges feladaton kívül másra is használná. Megváltozott a helyzet, megváltozott az igény, a moduláló jelek átállítják a rendszer elemeinek, és így egészének működését. Itt persze megint a modularitás és az emergencia jelenik meg.
Eddig valamelyest függetlenül beszéltünk a gliasejtekről és az idegsejtek tulajdonságainak hangolásáról, de fontos azt is megmutatni, hogy a két rendszer nem egymástól függetlenül működik, hanem két, részben párhuzamosan működő, de erősen összefüggő rendszert alkot. Az idegsejtek gyorsan dolgozzák fel a jeleket, a beérkező ingerületet összegzik és kimenő jellé alakítják. Ebben serkenthetőségük és szinapszisaik erősségének mindenkori állapota fontos szerepet játszik.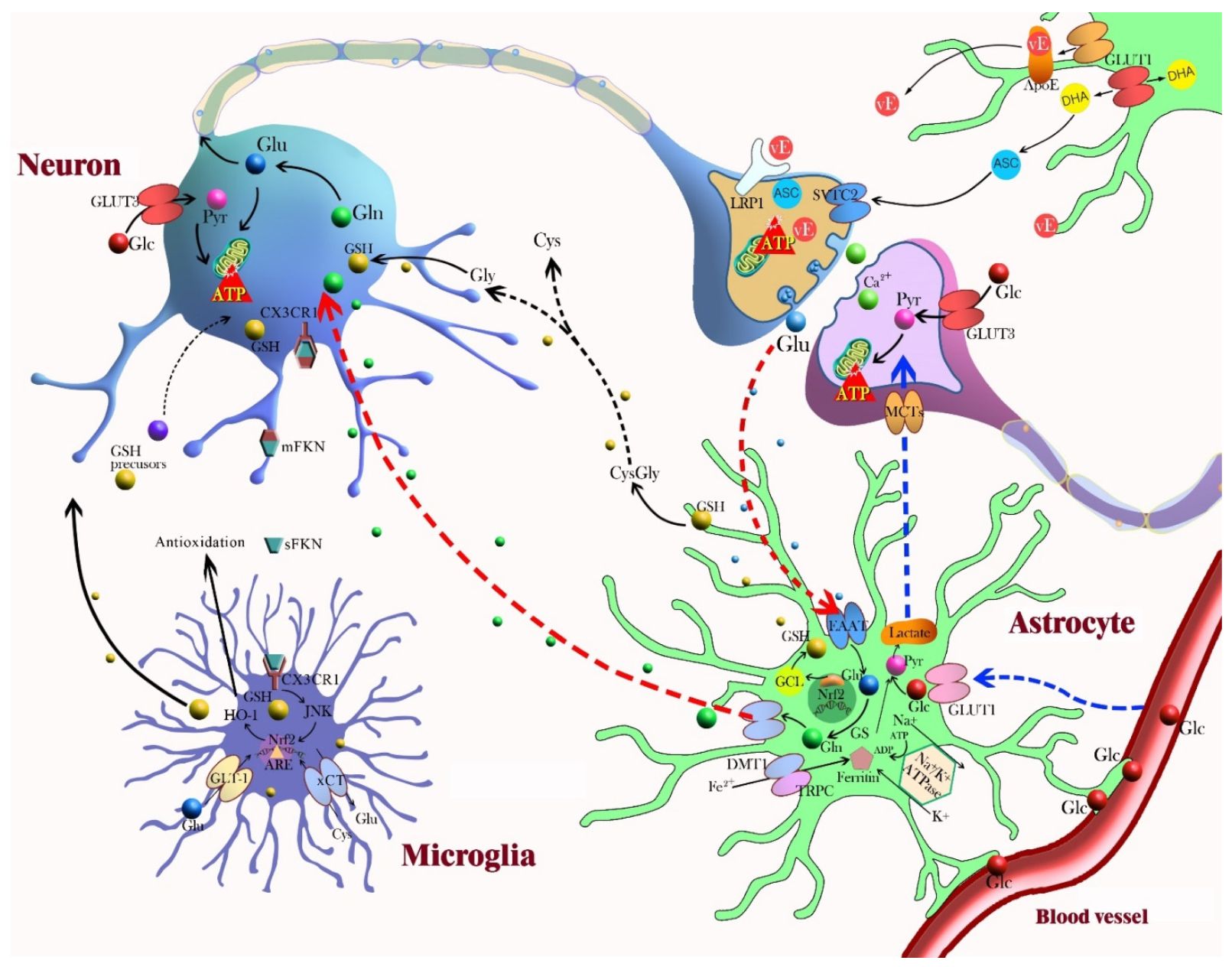 A gliasejtek komótosabbak, térben és időben nagy léptpékben követik az eseményeket és lassan reagálnak, lassú gyenge membránpotenciál változásokat mutatva, melyek lassú átlagai számos idegsejt membránpotenciáljának. Mivel az idegsejtek aktivitásának megfigyelésével és lassan visszacsatolt szabályozásával részt vesznek az idegsejtek anyagcseréjének, aktivitási szintjének, szinaptikus átvitelének szabályzásában, valamint a szinaptikus súlyok megváltozásának , a tanulásnak a szabályozásában, ők is részt vesznek az idegrendszer jelfeldolgozásában, csak egy másik időskálán (lásd az adenozin és az álmosság esetét az előző bejegyzésben). Mint a séta végén (sok van még ddig) látni fogjuk, az agy az aktuális feladat, a mindenkori magatartási állapot függvényében másodperces skálán módosítja működését, ehhez valószínűleg a gliasejtek is komolyan hozzájárulnak. Amikor az idegsejtek aktivitás gyorsan kezd el emelkedni, számos gliális mechanizmus indul be, amely biztosítja az agy kiegyensúlyozott működését, az agy homeosztázisát.
A gliasejtek komótosabbak, térben és időben nagy léptpékben követik az eseményeket és lassan reagálnak, lassú gyenge membránpotenciál változásokat mutatva, melyek lassú átlagai számos idegsejt membránpotenciáljának. Mivel az idegsejtek aktivitásának megfigyelésével és lassan visszacsatolt szabályozásával részt vesznek az idegsejtek anyagcseréjének, aktivitási szintjének, szinaptikus átvitelének szabályzásában, valamint a szinaptikus súlyok megváltozásának , a tanulásnak a szabályozásában, ők is részt vesznek az idegrendszer jelfeldolgozásában, csak egy másik időskálán (lásd az adenozin és az álmosság esetét az előző bejegyzésben). Mint a séta végén (sok van még ddig) látni fogjuk, az agy az aktuális feladat, a mindenkori magatartási állapot függvényében másodperces skálán módosítja működését, ehhez valószínűleg a gliasejtek is komolyan hozzájárulnak. Amikor az idegsejtek aktivitás gyorsan kezd el emelkedni, számos gliális mechanizmus indul be, amely biztosítja az agy kiegyensúlyozott működését, az agy homeosztázisát.
Szerző: Gulyás Attila





