VIP idegsejt mozi: feszültség érzékeny szenzorokkal láthatók az idegsejteken szaladgáló jelek
Egy idegsejtre másodpercenként sokezer serkentő és gátló szinaptikus áram érkezik, melyek bonyolult módon hatnak kölcsön. Az áramok a dendriteken terjedés közben erősödhetnek, gyengülhetnek, gyakran kalcium tüskéket váltanak ki.
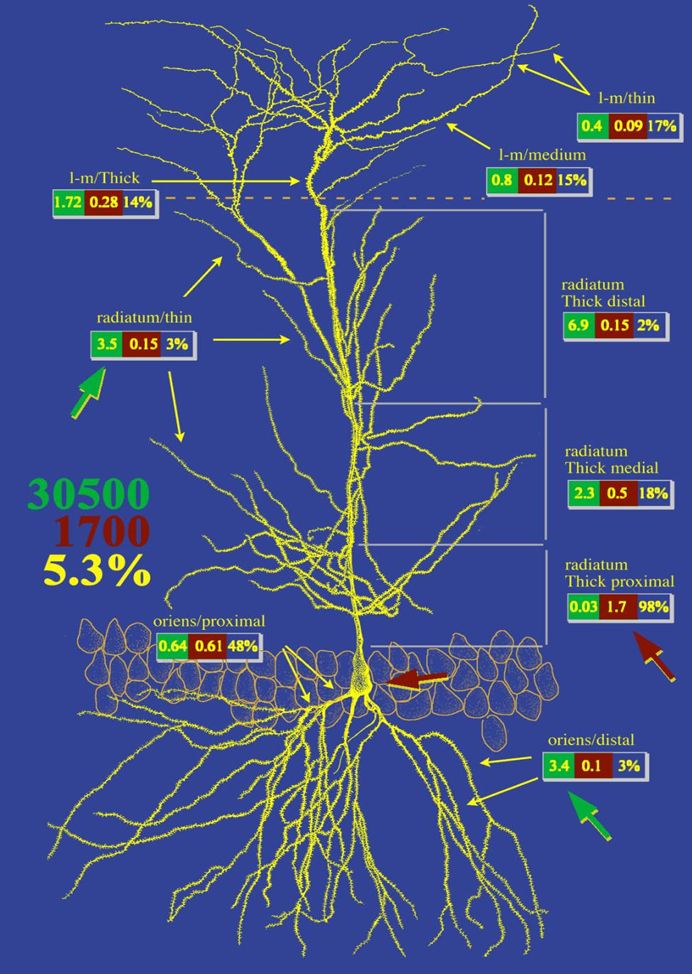 Mindezek eredményeként kellően serkentett esetben akciós potenciálok vagy kisüléssorozatok (burst-ök) keletkeznek az axon iniciális szegmentumon. A hab a tortán, hogy az állat viselkedésével összefüggésben felszabaduló moduláló ingerületátvivő anyagok hatására (acetil-kolin, szerotonin, dopamin, noradrenalin, etc.), az idegsejtek eltérő ingerfeldolgozási módokba kapcsolnak, azaz állapotonként máshogy terjednek és összegződnek a szinaptikus áramok.
Mindezek eredményeként kellően serkentett esetben akciós potenciálok vagy kisüléssorozatok (burst-ök) keletkeznek az axon iniciális szegmentumon. A hab a tortán, hogy az állat viselkedésével összefüggésben felszabaduló moduláló ingerületátvivő anyagok hatására (acetil-kolin, szerotonin, dopamin, noradrenalin, etc.), az idegsejtek eltérő ingerfeldolgozási módokba kapcsolnak, azaz állapotonként máshogy terjednek és összegződnek a szinaptikus áramok.
A jelfeldolgozás megértéséhez, hagyományosan elektródákkal (hegyes, patch-clamp) mérik a sejtek és dendritek potenciálját, és a rajtuk folyó áramokat — de ezekkel egyszerre csak egy vagy kevés ponton tudunk mérni. Ráadásul ezek a módszerek érzékenyek az állat vagy preparátum mozgására, emiatt nehezen használhatók, mivel az 1-20 µm átmérőjű sejteket és dendriteket nehéz megtartani az ehhez képest hatalmas elektród végén.
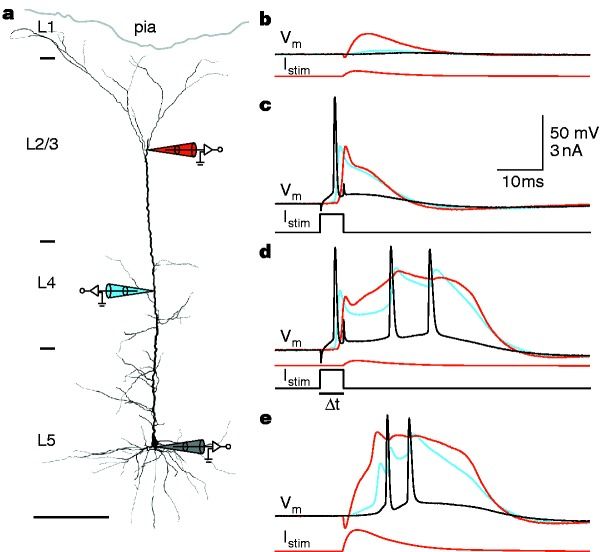
Képzeljük el milyen jó lenne, ha ahelyett, hogy elektródákat kellene szurkálnunk idegsejtekbe vagy agyterületekre, csak ránéznénk egy idegsejtre, és látnánk hogyan terjednek és összegződnek rajta az elektromos jelek, vagy látnánk az agyi hálózatokban csillogó mintázatokat. Erre ugye történt kísérlet a kalcium szenzorok terén, melyek használatával sokat megtudtunk a sejtek jelintegrációjáról. De, mint korábban írtam, ezek a szenzorok 50-100msec késéssel és meglehetősen nagy bizonytalansággal írják le a sejtekben történő feszültségváltozásokat. Ezért kísérleteznek jóideje a feszültség-érzékeny festékekkel (VSD=voltage sensitive dye) és genetikailag kódolt feszültség-érzékeny fehérjékkel (GEVI= genetically engineered voltage indicator), melyek gyorsan és közvetlenül érzékelik a membránpotenciált. Azonban számos technikai akadály miatt ezek az indikátorok gyenge teljesítményt nyújtottak. Mik voltak ezek az okok?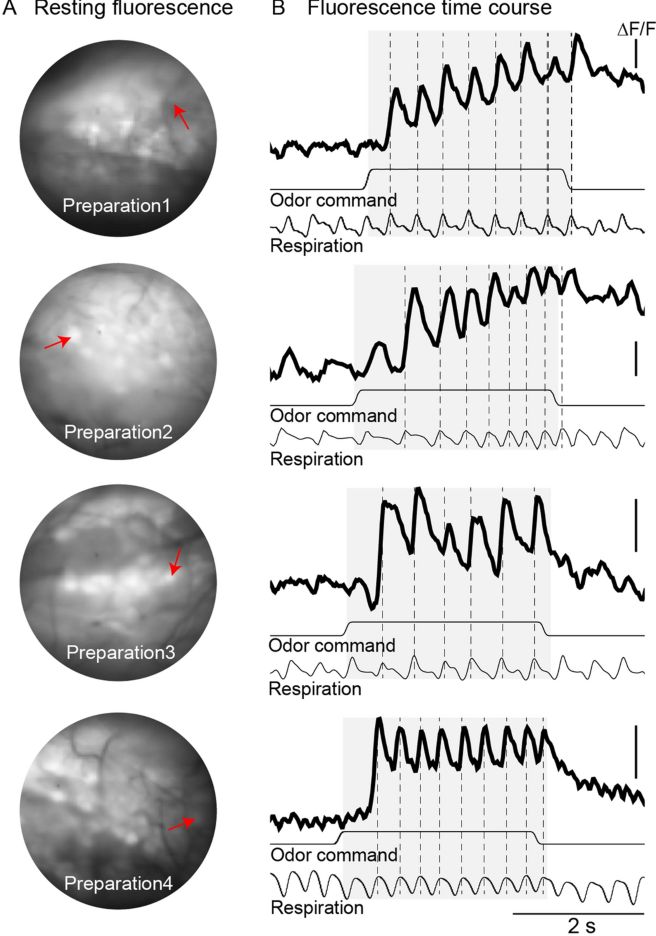 (1) A jel nagyon kicsi volt: Míg a Ca-szenzorok 50–150% fluoreszcenciaváltozást tudnak, a GEVI-k 2008–2016 között gyakran 1–5% ΔF/F tartományban mozogtak. Ez extrém jel/zaj problémát okozott. Hogy ez miért baj, legjobban azzal lehet szemléltetni, amikor nappal valaki be akar nézni egy ház ablakán. Nem fog sokat látni abból, ami bent történik, mivel kívül nagyon erős a háttérfény, és a visszaverődő fény sokkal erősebb, mint ami bentről kijön. Pedig hát este (vagy ha kezünkkel leárnyékoljuk a háttárfényt) jól látjuk mi történik bent, holott semmivel több fény nem jön ki bentről. Mindössze az összes fényhez képest kicsi a belső fény.
(1) A jel nagyon kicsi volt: Míg a Ca-szenzorok 50–150% fluoreszcenciaváltozást tudnak, a GEVI-k 2008–2016 között gyakran 1–5% ΔF/F tartományban mozogtak. Ez extrém jel/zaj problémát okozott. Hogy ez miért baj, legjobban azzal lehet szemléltetni, amikor nappal valaki be akar nézni egy ház ablakán. Nem fog sokat látni abból, ami bent történik, mivel kívül nagyon erős a háttérfény, és a visszaverődő fény sokkal erősebb, mint ami bentről kijön. Pedig hát este (vagy ha kezünkkel leárnyékoljuk a háttárfényt) jól látjuk mi történik bent, holott semmivel több fény nem jön ki bentről. Mindössze az összes fényhez képest kicsi a belső fény.
(2) A membránpotenciál-változás nagyon gyors (az akciós potenciál 1msec): Az érzékelésre használt kamera/képalkotó rendszer, illetve a szenzor fotofizikája nem tudta ilyen gyorsan követni a változást, a jelek elmosódtak.
(3) A festékek vagy nem voltak stabilok, vagy mérgezőek voltak: A szintetikus VSD-k egy része fototoxikus volt, megvilágítás hatására sejtkárosító szabadgyököket szabadított fel. A GEVI-k membráncélzása instabil/gyenge volt. Sok esetben a festék nem jutott megfelelően a membránba. Márpedig ott kell lennie, hiszen a sejthártya két oldala közötti feszültségkülönbségre vagyunk kíváncsiak. A sejtben maradt fehérje fluoreszcenciája nem változik, és emiatt háttérjelként rontja a jel-zaj viszonyt.
(4) A fényút és a szóródás (in vivo) sokkal kritikusabb a feszültség-képalkotásnál, mivel a kis jel miatt bármilyen szóródás vagy háttérfény gyengíti a hasznos jelet.
(5) A kalcium-imaging technikailag sokkal „megbocsátóbb” volt: nagy jel, lassú, „szélesen integráló” válasz. Jól működtek a már korábban standardizált két-foton rendszereken és széles körű optogenetikai kompatibilitás mutattak.
Miben javultak a feszültség-érzékeny szenzorok 2017–2024 között?
A régi GEVI-k (ArcLight, 2011) lassú válasza és gyenge jelkibocsájtása (1–5% ΔF/F) miatt egyedi sejteken alig volt detektálható AP-válasz. Ezeket felváltották a modern GEVI-k (ASAP3, ASAP4e, Ace-mNeon, Voltron / SomArchon / QuasAr3, 2018–2024), melyek gyorsak, kiváló fényerővel rendelkeznek, 10–20% ΔF/F-t mutatnak, azaz egyetlen AP-re jelet adnak. Sokuk vörös-eltolt fénnyel gerjeszthető és mivel a vörös fény kevésbé szóródik az agyszövetben, az agy mélyéről is lehet mérni velük. A sejttestet célzó Archon-t kifejezetten akciós potenciál (AP) követésére optimalizálták. Ezekkel az indikátorokkal már valódi akciós potenciál szintű felbontás lehetséges in vivo (azaz élő, viselkedő, ép agyú állatban), kHz-es sebességgel (azaz 1msec felbontással).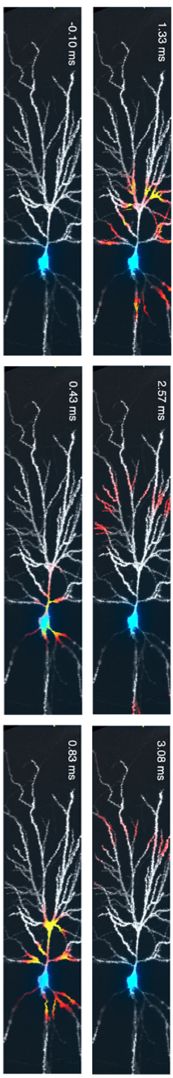
Mi fejlődött mindehhez?
(1) Jel/zaj drámai javulása: ΔF/F növelés és abszolút fényerő növelése.
(2) Sebesség: a kinetika ma már elég gyors, a szenzorok időállandója ~1 ms környékén van, tehát AP-ket torzítás nélkül követnek. Ráadásul küszöb alatti membránfeszütség ingadozásokat is mérnek (amit Ca-imaging nem tud) és így nagyot léphetünk előre a sejtek jelintegrációs tulajdonságainak megértésében. Ami nagyon fontos a finom kölcsönhatásokat is láthatjuk, nem csak az APket. Mondhatjuk azt, hogy a tömegben nem csak mérges kiabálást halljuk, hanem a halk beszélgetéseket is, amelyek gyakran többet mondanak.
(3) A membráncélzás és kifejeződés stabilitása javult: a festékek és fehérjék membrán-horgonyzó területeinek optimalizálásával (pl. Kv2.1 targeting) hatékonyabban épülnek be a sejtmembránba, illetve új fluorofórokat (fénykibocsájtó részeket: xGreen, mNeonGreen, mRuby3 variánsok) fejlesztettek. Ezek eredményeképpen nagyon egyenletes membránjelet, stabil hetekig jelen levő expressziót, és csökkenő fototoxicitást értek el. Azt se felejtsük el, hogy a genetikus módszerekkel el lehet érni, hogy a feszültség érzékelők csak egyes sejtekben fejeződjenek ki (bár ezt már a Ca indikátorok is tudták).
(4) Hibrid rendszereket fejlesztettek, melyekben egy fehérje specifikusan köt egy festéket (pl. Voltron). Ezekben a GEVI egy fehérjeváz, amelyhez kémiai fluorofór kötődik, így kombinálódik a szintetikus festékek fényereje a genetikai célzás pontosságával. Ez kétszeres-háromszoros jel/zaj erősödést hozott.
(5) A sebességnövekedést a képalkotó technológiák is követték. Megjelentek a nagy sebességű kamerák (sCMOS -> neurolight CMOS), a feszültség-leképezéshez (voltage-imaging) optimalizált LED-gerjesztő rendszerek, vörös-eltolt GEVI-k (635–660 nm), melyeket lehetővé teszik az agy mélyebb rétegeinek vizsgálatát.
Ennek eredményeképpen 2019–2024 között több tanulmány jelent meg, amelyek viselkedő egérben mutatja be egyetlen sejt feszültségváltozásait. Az agykéregben oszlop-szintű aktivitást térképeznek, küszöb alatt dendritikus jeleket mérnek a mélyen fekvő hippokampusz, agykéreg, talamusz és striátum területein.
A voltage-imaging végre elkezdte megmutatni, egyszerre egész hálózatokban és sok sejten azt, amit az elektrofiziológia eddig nehezen, körülményesen és évtizedek alatt a kulcslyukon keresztül meglesett: az akciós potenciál pontos időpontját és kialakulásának helyét, a küszöb alatti dendritikus jeleket, a sejtek közötti szinkronitást, a hálózati állapotok gyors váltásait. A kalcium-imaging továbbra is hasznos: több száz vagy ezer sejt aktivitását láthatjuk egyszerre vele. A két módszer nem versenyez, hanem kiegészíti egymást.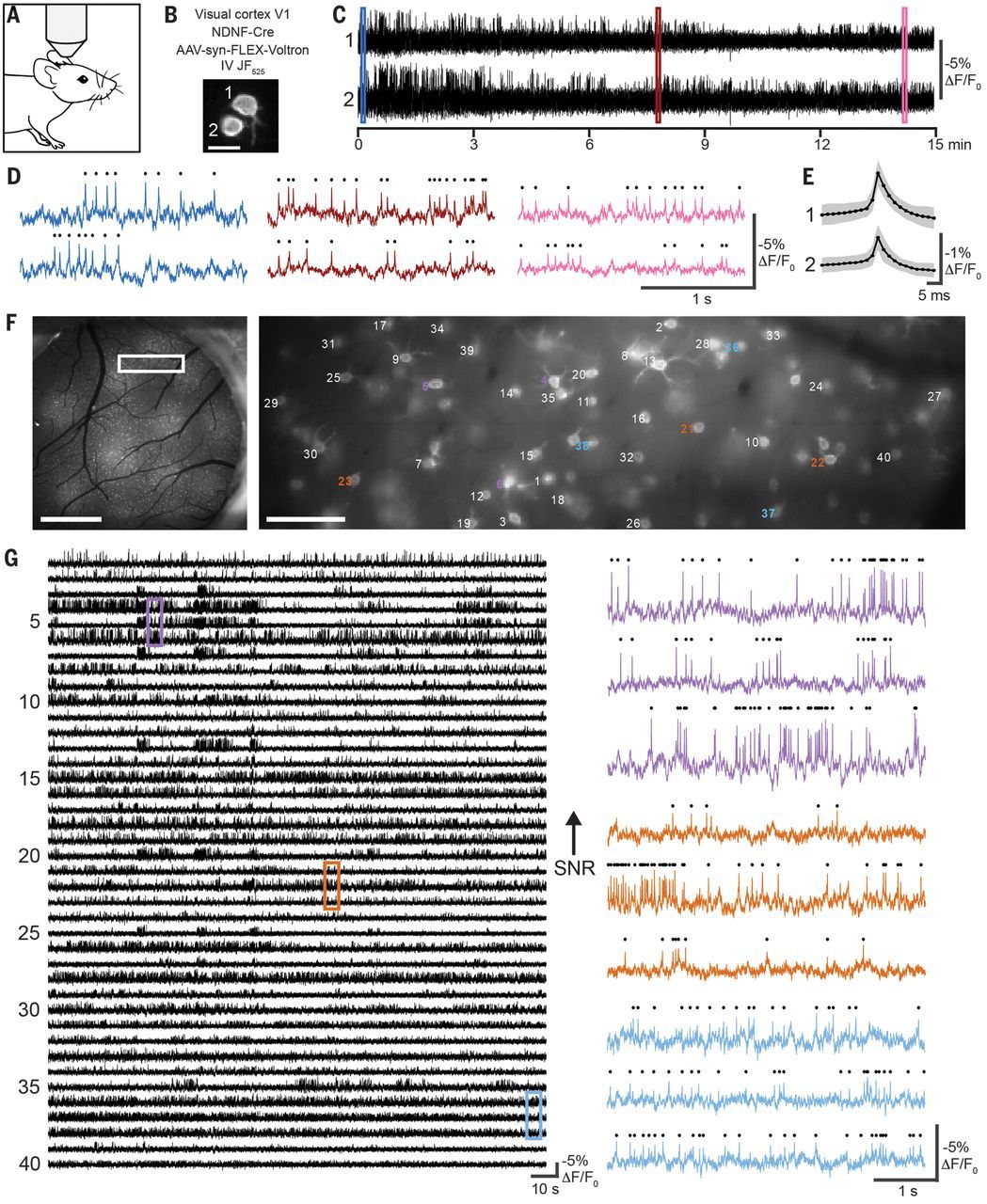
Mit jelent mindez laikus nyelven?
A feszültség-leképezés korábban olyan volt, mintha nagyon gyors eseményeket akartunk volna lefotózni egy régi mobiltelefonnal a sötétben. Mostanra viszont a kamera gyorsabb és fényérzékenyebb lett, a festék sokkal fényesebben világít, és célzottan oda tudjuk vinni, ahol történik az akció. Ezért történik az, hogy a 2020-as években a voltage imaging végre megbízható, gyors, élő állatban is működik, és olyan információt ad, amit Ca-imaging nem tud (pl. szinaptikus áramok terjedését és kölcsönhatását láthatjuk dendriteken, az AP-k időzítését msec pontossággal).
Egyenlőre ezzel zárjuk is az #agytecnikák mondern módszerekről szóló sorozatát.
Szerző: Gulyás Attila





