MikroProjet tervezés és felkészülés: fizsó, puffer, fixáló, jegyzőkönyv
Alapos ember mielőtt nekilát valaminek tervez. A kutató nagyon alapos, ezért alaposan tervez. A MikroProjekt lépéseit először átgondoltuk, majd megírtuk hozzá a kísérleti tervet, mely egyben majd jegyzőkönyv is lesz. Vezet minket utunkon és később pedig vissza tudjuk keresni mit hogyan csináltunk, miben tértünk el vagy kellet eltérnünk a tervezettől. A jegyzőkönyvezés nem csak nekünk segít, hanem elvárás is, hiszen munkánk hitelességét később is bizonyítanunk kell.
Mik is a lépések:
- Állattörzsek kiválasztása
- Oldatok készítése.
- Egéragyak fixálása
- Metszetek készítése
- Metszetek mosása, festése
- Metszetek tárgylemezre rakás
- Metszetek mikroszkópos vizsgálata, scannelése
- Adatok elemzése
No persze itt mindegyik lépés több részlépésre tagolódik.
A kiválasztott két törzs egyike a BAC-PV EGFP kódot viselte. Ez azt jelenti, hogy olyan transzgén állat, amibe egy BAC, bacterial artificital chromosome (mesterséges bakteriális kromoszóma) van bejuttatva, mely a parvabumin nevezetű kalcium köt fehérje promoterét és utána kötött EGFP kódját (enhanced green fluorescent protein, felerősített zöld fluoreszcens fehérje) hordozza. Az ilyen állatokban minden sejtben mely parvalbumint termel megjelenik a zöld fuoreszcens fehérje. Mivel a parvalbumin az izomsejtekben is jelen van (elősegíti azok gyors összehúzódását) gyakorlatilag UV lámpa alatt az egész állatka világít). Mi azért használtuk ezt a törzset, mert az idegrendszerben a parvalbumin a legerősebb gátlást kifejtő gátlósejteket jeleníti meg. Arra voltunk kíváncsiak a tanszgén állatban valóban ezek a sejtek világítanak-e. Azaz lehet-e őket arra használni hogy világításuk alapján PV tartalmú gátlósejteket tudjunk elcsípni.
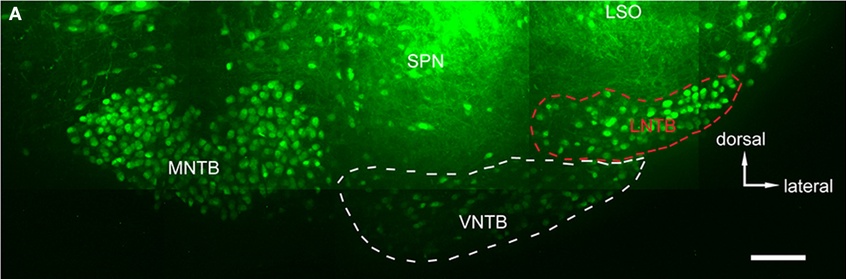 A másik törzs kódja BAC GlyT2 EGFP volt. A GlyT2, a glicin nevű aminosavat vezikulákba töltő transporter fehérje génjének a rövidítése. Azok a sejtek, melyek glicint használnak átvivőanyagként kifejezik ezt az anyagot és a transzgén állatban az EGFPt mely a sejt teljes nyúlványrendszerét kitölti. A glicin a GABAhoz hasonló hatású gátló ingerületátvivő anyag. Először e gerincvelőben írták le, hogy a glicinrészt vesz az idegi ingerületátvitelben, de később számos agyi pályában is megtalálták. Ha ellenőrzésünk sikerrel jár tudni fogjuk, hogy ebben az állatban a glicint használó idegsejtek és pályák jelülődnek.
A másik törzs kódja BAC GlyT2 EGFP volt. A GlyT2, a glicin nevű aminosavat vezikulákba töltő transporter fehérje génjének a rövidítése. Azok a sejtek, melyek glicint használnak átvivőanyagként kifejezik ezt az anyagot és a transzgén állatban az EGFPt mely a sejt teljes nyúlványrendszerét kitölti. A glicin a GABAhoz hasonló hatású gátló ingerületátvivő anyag. Először e gerincvelőben írták le, hogy a glicinrészt vesz az idegi ingerületátvitelben, de később számos agyi pályában is megtalálták. Ha ellenőrzésünk sikerrel jár tudni fogjuk, hogy ebben az állatban a glicint használó idegsejtek és pályák jelülődnek.
Terveink szerint mindkét állattörzsből 2-2 állatból készítünk metszeteket (egy mérés ugye nem mérés, ennél nagyobb elemszámokkal szoktak a kutatók dolgozni, de egy felderítő diák projektnél a 2-2 elfogadható). Ezek egy részét nem festjük csak fluoreszcens mikroszkópban vizsgáljuk a jeleket. Egy-egy sorozaton azonban kettős immunfestést végzünk, egyrészt zöld fluoreszcenciával felerősítjük az EGFP jelet, másrészt a PV állatban PV ellen festve piros fluoreszcenciával megjelöljük a PV tartalmú sejteket, a GlyT2 állatban pedig egy másik kalcium kötő fehérje ellen a Calbindin ellen festünk pirossal. A PV esetében szeretnénk meggyőződni arról, hogy a transzgén kifejeződése helyes-e, azaz csak PV sejtekben van jelen, de azokban mindig. GlyT2 állat esetében azt vizsgáljuk, hogy a Calbindint kifejező gátlósejt csoport mennyire fed át a glicint transzmitterként használó gátlósejt csoporttal.
 Hogyan tovább?
Hogyan tovább?
Az agyak fixálásához az elaltatott egerek vérkeringését először 4 C fokos fiziológiás sóoldattal, majd 4 C fokos 4% paraformaldehidet tartalmazó 0.1M (mólos) foszfát pufferrel kell átöblíteni. Mint korábban írtuk, a véráramon keresztül lehet az agyba megfelelőn gyorsan eljuttatni a fixálót.
A fentiekhez fiziológiás sóoldatra (röviden fizsó) és 0.2M pH=7.4 PB-re (angolul phosphate buffer, foszfát puffer) és a fent említett fixálóra van szükségünk. Ezeket a kísérlet kezdete előtti napon készítettük el, hogy legyen idejük lehűlni. Annak rendje és módja szerint volt mérőhenger, főzőpohár, köpeny, precíziós mérleg meg minden. Az oldatkészítésről és egyebekről készült jegyzőkönyv itt tekinthető meg.
De miért is kell a fizsó meg a puffer? Azért, mert élő, vagy nemrég élt rendszerrel dolgozunk. A szervezetünket és az egér szervezetét is alkotó fehérjék kényes molekulák, mint Borsószem királykisasszony. Eredeti szerkezetüket és működésüket csak akkor őrzik meg ha megfelelő a környezet ionkoncentrációja, kémhatása (pH-ja) és hőmérséklete. Ezt szervezet ionkoncentrációjával megegyező sótartalmú 0.9% os NaCl (konyhasó) oldat, illetve még pontosabban a 0.1M pH=7.4 PB biztosítja.
Egy hétvégére aztán beköltöztünk az Intézet egyik laborjába (köszönet érte Acsády Lászlónak, Bokor Hajnalkának és Faddi Krisztinának).
A fixálást az egerek altatásával kezdtük. Először altatógázzal elkábítottam őket, hogy nyugodtak legyenek és ne érezzen fájdalmat amikor a hasüregükbe adtam az altatót. A mélyen alvó egerek keringési rendszerét azután fizsóval, majd fixálóval öblítettem át. Ez egy 40 peres folyamat, melynek végére az agy radírgumi keménységűvé válik. Ez kell ahhoz, hogy később vékony metszeteket tudjunk vágni az agyból. Az agyakat finom ollók és csipeszek segítségével a fiatal kuatópalánták kivették a koponyából és elkezdtük kimosni belőlül a fixálót többször cserélt 0.1 PBvel. Aki résen van láthatta a szövegből, hogy a diákok csak azután nyúlhattak az állatokhoz miután azok már nem éltek. Az EUban és Magyarországon is szigorú szabályok szerint szabad csak állatkísérleteket végezni. Csak azok dolgozhatnak állatokkal akik megfelelő vizsgával és engedélyekkel rendelkeznek, ismerik azt hogyan kell az állatokkal humánusan, stresszmentesen dolgozni.
 A következő lépés az teljes egér agyak lemetszése volt. Mivel kérdésünk az, hogy az egér teljes agyában hol találhatók meg a PV és GlyT2 sejtek és nyúlványaik, ezért az egész agyat kell metszenünk. Egy egér agy kb 1.5 cm hosszú. Rutinszerűen nem vág az ember vastagabb metszeteket mikroszkópiára, mint 100 mikrométer, mert ha túl vastagok a metszetek a mikroszkópok nem képesek átfókuszálni őket, illetve nehéz a festésük és az optikai tulajdonságaik sem jók. Azaz nekünk egerenként kb. 150darab 100
A következő lépés az teljes egér agyak lemetszése volt. Mivel kérdésünk az, hogy az egér teljes agyában hol találhatók meg a PV és GlyT2 sejtek és nyúlványaik, ezért az egész agyat kell metszenünk. Egy egér agy kb 1.5 cm hosszú. Rutinszerűen nem vág az ember vastagabb metszeteket mikroszkópiára, mint 100 mikrométer, mert ha túl vastagok a metszetek a mikroszkópok nem képesek átfókuszálni őket, illetve nehéz a festésük és az optikai tulajdonságaik sem jók. Azaz nekünk egerenként kb. 150darab 100 mikronos metszetet kellett vágnunk. Hogy egy-egy sorozatban kezelhető mennyiségű metszetünk legyen, állatonként 4-4 üvegbe szedtük fel a metszeteket körkörösen. Így egymástól 400 mikronra levő koronális szeletek kerültek egy-egy üvegbe az agy összes részéről.
mikronos metszetet kellett vágnunk. Hogy egy-egy sorozatban kezelhető mennyiségű metszetünk legyen, állatonként 4-4 üvegbe szedtük fel a metszeteket körkörösen. Így egymástól 400 mikronra levő koronális szeletek kerültek egy-egy üvegbe az agy összes részéről.
A metszeteket egy Vibratome nevű szerkentyűn készítettük, melynek asztalkájára kell felragasztani az agyakat és a 100 mikrométeres lépésekben emelkedő agyak felszínéről egy gyorsan rezgő borotvapenge választja le a metszeteket. Azokat finom ecsettel helyezzük el a pufferrel töltött üvegcsékbe, figyelve a helyes sorrendre. Minden diáknak jutott a mókából és ügyesen, ha elsőre nem is gyorsan lemetszették az agyakat. Ezután jött az uncsi rész. Az üvegcsékben úszkáló metszetekről egy Pasteur-pipettával óvatosan leszívjuk a puffert és új, tiszta puffert teszünk rá. Ezt a lépést 10 percenként 4x megismételjük, hogy az immunfestést ne tegye tönkre a metszetekben maradt aldehid.
Ezután jött az uncsi rész. Az üvegcsékben úszkáló metszetekről egy Pasteur-pipettával óvatosan leszívjuk a puffert és új, tiszta puffert teszünk rá. Ezt a lépést 10 percenként 4x megismételjük, hogy az immunfestést ne tegye tönkre a metszetekben maradt aldehid.
Folyt köv.
Szerző: Gulyás Attila





